1、选择题 在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol·L-1。在此段时间内用H2表示的平均反应速率为0.45 mol·(L·s)-1。则反应所经过的时间是(? )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol·L-1。在此段时间内用H2表示的平均反应速率为0.45 mol·(L·s)-1。则反应所经过的时间是(? )
A.0.44 s
B.1 s
C.1.33 s
D.2 s
参考答案:D
本题解析:用NH3表示的反应速率为v(NH3)=2/3v(H2)="2/3×0.45" mol·L-1·s-1="0.3" mol·L-1·s-1,设所用时间为t,则0.3 mol·(L·s)-1×t="0.6" mol·L-1,t="2" s,故选D。
本题难度:一般
2、选择题 下列变化不能用勒夏特列原理解释的是?
A.红棕色的NO2加压后颜色先变深再变浅
B.H2、I2、HI混合气体加压后颜色变深
C.向H2S水溶液中加入NaOH有利于S2-增多
D.打开汽水瓶,看到有大量的气泡逸出
参考答案:B
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系,据此可知,选项ACD都可以通过勒夏特例原理解释。B中反应是体积不变的可逆反应,改变压强平衡不移动,不能用勒夏特例原理解释,答案选B。
点评:该题是中等难度的试题,试题主要是考查学生对勒夏特例原理的熟悉了解掌握程度,以及灵活运用勒夏特例原理解决实际问题的能力,有助于培养学生的灵活应变能力和答题的应试能力。
本题难度:简单
3、选择题 在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)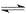 Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
温度℃
| 25
| 80
| 230
|
平衡常数
| 5×104
| 2
| 1.9×10-5
|
?
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)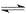 Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
参考答案:D
本题解析:
由已知的数据可以看出,升高温度,平衡常数减少,说明平衡向逆方向移动,正反应是放热反应,A错;25℃时反应Ni(CO)4(g)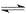 Ni(s)+4CO(g)时,它平衡常数是1/(5×104),B错;80℃时,Qc=0.5/0.54>2,说明平衡向逆方向移动,C错;80℃时,假定n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L,代入平衡常数表达有,2/(0.3/0.3L)4=2,所以假定成立,D正确。答案选D
Ni(s)+4CO(g)时,它平衡常数是1/(5×104),B错;80℃时,Qc=0.5/0.54>2,说明平衡向逆方向移动,C错;80℃时,假定n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L,代入平衡常数表达有,2/(0.3/0.3L)4=2,所以假定成立,D正确。答案选D
本题难度:一般
4、填空题 有a、b两个等体积且极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等。在相同条件下将3mol?A,1mol?B分别同时混合于a、b两容器中,发生反应:3A(g)+B(g) ?2C(g)+D(g)
?2C(g)+D(g)
(1)达到平衡时,a中A的浓度为M?mol/L。A的转化率为N,b中A的浓度为m?mol/L,A的转化率为n,则M____m;N_____n(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后,a中A的浓度为M?mol·L-1的是____________?
A?6mol?A+2mol?B?
B?3mol?A+2mol?C?
C?2mol?C+1mol?B+1mol?D
D?2mol?C+1mol?D?
E?1.5mol?C+0.5mol?B+1mol?C+0.5mol?D
参考答案:(1)<?; <?
(2)D、E
本题解析:
本题难度:一般
5、选择题 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3 X(g)+Y(g)  ?2 Z(g)?ΔH<0保持温度不变,测得平衡时的有关数据如下:
?2 Z(g)?ΔH<0保持温度不变,测得平衡时的有关数据如下:
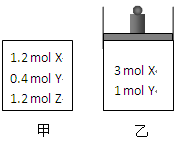
?
| 恒容容器甲
| 恒压容器乙
|
X的物质的量(mol)
| n1
| n2
|
Z的体积分数
| φ1
| φ2
|
下列说法正确的是
A.平衡时容器乙的容积一定比反应前小? B.平衡时容器甲的压强一定比反应前小
C.n2>n1? D.φ2>φ1
参考答案:AD
本题解析:两容器中的起始量均可以看作是3molX和1molY。因为正反应是体积减小的可逆反应,即若保持容器体积不变,则压强是减小的,而乙容器则是保持恒压,这说明在反应过程中乙中的压强始终大于甲中的,而压强越大,反应物的转化率越高,所以答案是AD。
本题难度:一般