1、选择题 下列有关化学用语表示正确的是?
A.四氯化碳分子比例模型: 
B.COS的电子式是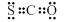
C.次氯酸的结构式为 H-Cl-O
D. O2-离子结构示意图:
O2-离子结构示意图: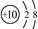
参考答案:B
本题解析:A、氯原子半径比碳原子大,错误;B、均形成八电子稳定结构,正确;C、次氯酸为角型分子,应为H-O-Cl,错误:D、氧的核电荷数=质子数=8
本题难度:简单
2、计算题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
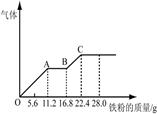
(1)两份各自产生的NO气体物质的量 (填“相等”或“不相等”)
(2)硝酸的物质的量浓度 ,硫酸的物质的量浓度 。
参考答案:(6分)(1)相等 (2分) (2)2mol·L-1 4mol·L-1 (各2分)(无单位扣一分)
本题解析:(1)根据Fe与稀硫酸、稀硝酸反应的图像判断,OA段是Fe与硝酸反应生成硝酸铁、NO、水,AB段气体的物质的量不再增加,且铁离子的氧化性大于氢离子的氧化性,所以AB端发生的是Fe与铁离子的反应生成亚铁离子,随后再加入Fe,又产生气体,说明BC段是Fe与稀硫酸反应产生氢气。说明硝酸根离子被全部还原为NO,则该混酸与Fe、Cu反应产生的NO相等;
(2)根据Fe与稀硫酸、稀硝酸反应的离子方程式可知Fe+4H++NO3-=Fe3++NO↑+2H2O,可知与100mL的混酸反应中,与硝酸反应的Fe的质量是11.2g,物质的量是11.2g/56g/mol=0.2mol,则硝酸根离子的物质的量也是0.2mol,所以硝酸的物质的量浓度是0.2mol/0.1L=2mol/L;当加入Fe的质量是22.4g时不再产生气体,此时反应停止,所得溶液为硫酸亚铁溶液,22.4gFe的物质的量是22.4g/56g/mol=0.4mol,则100mL溶液中硫酸的物质的量是0.4mol,物质的量浓度是0.4mol/0.1L=4mol/L。
考点:考查对图像的分析,Fe、Cu与稀硫酸、稀硝酸反应的计算
本题难度:一般
3、简答题 在1Lamo1?L-1AlCl3溶液中加入1Lbmo1?L-1NaOH溶液
(1)当b≤3a时,生成Al(OH)3的物质的量为______mol;
(2)当a、b满足______条件时无沉淀生成;
(3)当a、b满足______条件时,b增大,沉淀量减少,此时生成沉淀的质量______g.
参考答案:已知反应:
AlCl3+3NaOH=Al(OH)3↓+3NaCl?
1?3
a?b?
AlCl3+4NaOH=NaAlO2+2H2O
?1?4?
?a?b?
当b=3a时刚好完全沉淀,b=4a时刚好无沉淀生成,
则(1)当b≤3a时,NaOH不足,NaOH完全反应生成Al(OH)3 沉淀,
生成Al(OH)3的物质的量为:n(Al(OH)3)=13n(NaOH)=b3mol,
故答案为:b3mol;
(2)由反应AlCl3+4NaOH=NaAlO2+2H2O可知,b≥4a时无沉淀产生,故答案为:b≥4a;
(3)由反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl、AlCl3+4NaOH=NaAlO2+2H2O,
可知:3a<b<4a时,先有沉淀产生后部分溶解,则
AlCl3+3NaOH=Al(OH)3↓+3NaCl?
a?3a?a
Al(OH)3↓+NaOH=NaAlO2+2H2O
1? 1
(b-3a)?(b-3a)?
所以最后剩余n(Al(OH)3 )=[a-(b-3a)]mol=(4a-b)mol,
m(Al(OH)3 )=(4a-b)mol×78g/mol=78×(4a-b)g=312ag-78bg
故答案为:312a-78b.
本题解析:
本题难度:一般
4、选择题 下列类型的反应中,一定不属于氧化还原反应的是(? )。
A.化合反应
B.置换反应
C.分解反应
D.复分解反应
参考答案:D
本题解析:四种基本反应类型与氧化还原反应的关系是:有单质参加的化合反应、有单质生成的分解反应属于氧化还原反应,所有的置换反应都是氧化还原反应,所有的复分解反应都不是氧化还原反应。故一定不属于氧化还原反应的是复分解反应。选项为D.
本题难度:简单
5、选择题 矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是
A.Na[Au(CN)2]不溶于水
B.化合物Na[Au(CN)2]中金元素的化合价为+1
C.金元素在地壳中能以化合态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
参考答案:B
本题解析:A、钠盐均是溶于水的,故A错误;B、钠的化合价为+1,C的为+2,N的为-3,故金的化合价为+1,B正确;由方程式①可得在矿石中存在金单质,故C错误;在反应①中金做还原剂,在反应②中含金物质做氧化剂,故D错误;故选B。
本题难度:一般