1、选择题 在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A.加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl-
B.新制氯水使红玫瑰变为白玫瑰,说明有Cl2
C.将NaHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D.光照新制氯水有气泡逸出,该气体一定是Cl2
参考答案:A、新制氯水中存在氯化氢,加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生说明有Cl-,故正确;
B、新制氯水中存在次氯酸,使红玫瑰变为白玫瑰,说明有次氯酸,故B错误;
C、新制氯水中存在氯化氢,将NaHCO3固体加入新制的氯水中,有气泡产生,说明有H+;故C错误;
D、新制氯水中存在次氯酸,光照新制氯水有气泡逸出,是次氯酸见光分解生成的气体是氧气,故D错误;
故选A.
本题解析:
本题难度:一般
2、简答题 (18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。

仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl2与FeBr2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol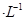 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl2先将Fe2+氧化生成Fe3+,溶液逐渐变黄色,Cl2再把Br-氧化成Br2,溶液变为棕黄色。
假设2:Cl2先将Br-氧化生成Br2,溶液逐渐变黄色,Cl2再把Fe2+氧化成Fe3+,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl2、Fe3+、Br2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,写出反应的离子方程式:________ 。
参考答案:(18分)
(1)分液漏斗(1分)?饱和食盐水(2分)除去尾气中的氯气防止污染空气(2分)
MnO2+4H++2Cl? Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)①取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。(3分)或取少量上述黄色溶液于试管中,向其中滴加少量CCl4,震荡,若CCl4层呈现橙红色,说明假设2对,否则不成立。(3分)
②取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl4,震荡静置(2分) Cl2 > Br2 >Fe3+(2分)
假设1(1分)
(3)2Fe2++2Br?+2Cl2 = 2Fe3++Br2+4Cl?(3分)
本题解析:(1)根据实验装置图,仪器A的名称为分液漏斗;MnO2与浓盐酸反应制取的氯气中含有HCl和水分,所以装置C中的试剂是饱和食盐水,作用是吸收HCl杂质;氯气有毒,不能排放到大气中,所以装置F的作用是:除去尾气中的氯气防止污染空气;MnO2与浓盐酸反应生成MnCl2、Cl2、H2O,离子方程式为:MnO2+4H++2Cl? Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)①根据假设①设计实验方案,应检验溶液中是否含有Fe3+,所以实验操作、现象和结论为:取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。根据假设②设计实验方案,应检验溶液中是否含有Br2,所以实验操作、现象和结论为:取少量上述黄色溶液于试管中,向其中滴加少量CCl4,震荡,若CCl4层呈现橙红色,说明假设2对,否则不成立。
②实验现象为:CCl4层由无色变为橙色,说明生成了Br2,应加入Cl2,所以实验操作为:取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl4,震荡静置;根据氧化剂的氧化性大于氧化产物的氧化性可得氧化性由强到弱的顺序为:Cl2 > Br2 >Fe3+;还原性由强到弱的顺序为:Fe2+ > Br? > Cl?,所以Cl2先氧化还原性强的Fe2+,故假设①合理。
(3)向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,Cl2先氧化0.1mol Fe2+,消耗Cl2 0.05mol,剩余的0.05mol Cl2再氧化0.1mol Br?,所以离子方程式为:2Fe2++2Br?+2Cl2 = 2Fe3++Br2+4Cl?
本题难度:一般
3、选择题 氯水中存在多种分子和离子,可通过实验的方法加以确定。下列有关氯水中存在粒子的说法正确的是( )
A.加入有色布条,一会儿有色布条褪色,证明有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,证明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液,产生白色沉淀,证明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,证明有HClO分子存在
参考答案:B
本题解析:使有色布条褪色的是HClO,错误;B、Cl2我黄绿色,所以溶液呈黄绿色,且有刺激性气味,证明有Cl2分子存在,正确;C、盐酸含有Cl?,所以先加入盐酸酸化,再加入AgNO3溶液,产生白色沉淀,不能证明Cl-存在,错误;D、加入NaOH溶液,氯水黄绿色消失,说明Cl2与NaOH发生反应,错误。
本题难度:简单
4、选择题 往氯水中滴加紫色石蕊试剂,下列现象描述正确的是?(?)。
A.溶液迅速褪为无色
B.溶液变为红色
C.溶液先变红,后褪色
D.溶液不变色
参考答案:C
本题解析:略
本题难度:一般
5、选择题 城市里常用氯气给自来水消毒,某城市的学生用自来水配制下列物质的溶液,可能产生白色沉淀的是
A.石蕊
B.硝酸银
C.碳酸氢钠
D.氯化铝
参考答案:B
本题解析:氯气能溶于水,常温常压下1体积水约能溶解2体积氯气,溶于水中的部分氯气能与水反应生成盐酸和次氯酸,所以用氯气给自来水消毒,水中含有极少量的氯离子,当遇到硝酸银溶液时,有不溶于水的氯化银白色沉淀生成,B正确;
本题难度:简单