1、填空题 现有以下物质:①KOH固体②液态HCl ③盐酸 ④熔融KCl ⑤蔗糖 ⑥铜⑦CO2 ⑧H2SO4
请将序号填在横线上
⑴ 以上物质中能导电的是_____?___,
⑵ 以上物质中属于电解质的是___?__?___,
⑶ 以上物质中属于非电解质的是__?__?_。
参考答案:⑴ ③④⑥
⑵ ①②④⑧
⑶ ⑤⑦
本题解析:略
本题难度:简单
2、选择题 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
[? ]
A.?[HCN]<[CN-]?
B.?[Na+]>[CN-]
C.?[HCN]-[CN-]=[OH-]?
D.?[HCN]+[CN-]=0.1mol/L
参考答案:BD
本题解析:
本题难度:一般
3、选择题 常温下,将甲酸和氢氧化钠溶液混合,所得溶液?pH=7,则此溶液中( )
A.[HCOO-]>[Na+]
B.[HCOO-]<[Na+]
C.[HCOO-]=[Na+]
D.无法确定[HCOO-]与[Na+]的关系
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列物 质不
质不 是电解质的是(? )
是电解质的是(? )
A.Na2SO4
B.NaOH
C.O2
D.HCl
参考答案:C
本题解析:略
本题难度:简单
5、填空题 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题
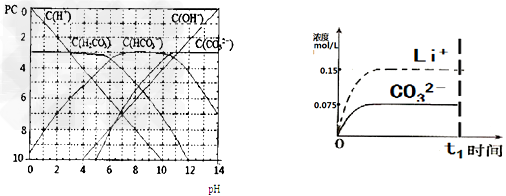
(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
_____________________(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1≈_____________?
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确_______________。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100?mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15?mol·L-1。c(CO32-)=0.075?mol·L-1若t1时刻在上述体系中加入100?mL0.125?mol·L-1?Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+?,实线表示CO32-)。
参考答案:(1)HCO3-  CO32-+H+、HCO3-
CO32-+H+、HCO3- H2CO3+OH-?
H2CO3+OH-?
(2)10-6?
(3)用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确
(4)c(Li+)=0.075mol/l、c(CO32-)=0.01mol/l,Qc=c(CO32-)·c2(Li+)=5.6×10-5< Ksp,无沉淀(5)

本题解析:
本题难度:一般