1、选择题 在下列反应中,HCl作还原剂的是(?)
A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
B.Zn+2HCl=ZnCl2+H2↑
C.NaOH+HCl=NaCl+H2O
D.CuO+2HCl=CuCl2+H2O
参考答案:A
本题解析:氯化氢作还原剂,氯化氢中的氢元素的化合价是最高价,所以氢元素不能再失去电子,故氯化氢中的氯元素失电子化合价升高,据此判断即可。A、MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑反应中,氯元素的化合价升高,氢元素的化合价不变,所以HCl是还原剂,故A正确;B、Zn+2HCl═ZnCl2+H2↑反应中,氯元素的化合价不变,氢元素的化合价降低,所以HCl是氧化剂,B错误;C、NaOH+HCl═NaCl+H2O反应中,氯元素化合价不变,所以HCl不是还原剂,故C错误;D、CuO+2HCl═CuCl2+H2O反应中,氯元素的化合价不变,氢元素的化合价不变,所以HCl不是还原剂,故D错误,答案选C。
MnCl2+2H2O+Cl2↑反应中,氯元素的化合价升高,氢元素的化合价不变,所以HCl是还原剂,故A正确;B、Zn+2HCl═ZnCl2+H2↑反应中,氯元素的化合价不变,氢元素的化合价降低,所以HCl是氧化剂,B错误;C、NaOH+HCl═NaCl+H2O反应中,氯元素化合价不变,所以HCl不是还原剂,故C错误;D、CuO+2HCl═CuCl2+H2O反应中,氯元素的化合价不变,氢元素的化合价不变,所以HCl不是还原剂,故D错误,答案选C。
本题难度:一般
2、选择题 下列变化,加入氧化剂才能实现的是
A.Na2S→H2S
B.CO2→CO
C.FeO→Fe2O3
D.AlCl3→Al(OH)3
参考答案:C
本题解析:在氧化还原反应中氧化剂得到电子,有关元素的化合价降低。如果在反应中需要加入氧化剂才能实现,这说明该微粒是还原剂,失去电子,有关元素的化合价升高,据此可以判断。A、在转化Na2S→H2S中元素的化合价均不变,不是氧化还原反应,加入酸即可实现,A不正确;B、在反应CO2→CO中碳元素的化合价由+4价降低到+2价,需要得到电子,因此需要加入还原剂才能实现,B不正确;C、在反应FeO→Fe2O3中铁元素的化合价由+2价升高到+3价,失去电子,因此需要加入氧化剂才能实现,C正确;D、在反应AlCl3→Al(OH)3中元素的化合价不变,不是氧化还原反应,通入氨气即可,D不正确,答案选C。
本题难度:一般
3、填空题 硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
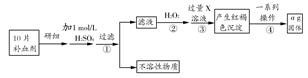
请回答下列问题:
(1)步骤②加入过量H2O2的目的是?。
(2)步骤③中反应的离子方程式为?。
(3)步骤④中的一系列操作依次为:过滤、?、灼烧、?、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为?g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。反应原理为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器为?;
②上述实验中的KMnO4溶液需要酸化,可用于酸化的酸是?。
a.稀硝酸 ?b.稀硫酸 ?c.稀盐酸 ?d.浓硝酸
参考答案:(1)将 Fe2+全部氧化为Fe3+
(2)Fe3++3OH-=Fe(OH)3↓
(3)洗涤 冷却
(4)112a/1600
(5)①250 mL容量瓶 ②b
本题解析:该流程图中的实验原理是:用H2O2将一定质量FeSO4·7H2O中的Fe2+氧化为Fe3+,然后加入碱溶液,将Fe3+转化为Fe(OH)3沉淀,经过一系列操作,得到a g Fe2O3固体,据此确定补血剂中铁元素的含量。
(1)为了保证Fe2+被完全氧化为Fe3+且使Fe3+完全沉淀,实验中所加的H2O2和碱溶液都应是过量的。
(2)在步骤③中,Fe3+与加入的碱溶液反应生成Fe(OH)3沉淀。
(3)在步骤④中,经过过滤得到Fe(OH)3沉淀;为了除去沉淀中的杂质,要洗涤沉淀;然后对沉淀进行充分灼烧;冷却后,称量所得到的Fe2O3固体。
(4)10片补血剂中一共含铁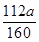 g,则每片补血剂中含铁
g,则每片补血剂中含铁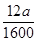 g。
g。
(5)精确配制一定物质的量浓度的KMnO4溶液250 mL,还需要的最主要仪器是250 mL容量瓶。高锰酸钾有强氧化性,能氧化盐酸,不能用盐酸酸化;硝酸有强氧化性,能氧化Fe2+,也不能酸化高锰酸钾溶液;选用稀硫酸酸化较合适。
本题难度:一般
4、选择题 在8NH3+3Cl2=N2+6NH4Cl反应中,在该反应中氧化剂和还原剂的分子个数之比是(? )。
A.3:1
B.3:8
C.3:2
D.8:3
参考答案:C
本题解析:氧化剂是Cl2,还原剂是NH3,8 mol NH3参与反应,其中只有2mol NH3被氧化。
本题难度:一般
5、填空题 我国是燃煤大国,治理燃煤产生的二氧化硫成为减少大气中二氧化硫含量和减轻酸雨危害的重要途径。下图所示为石灰石-石膏法脱硫示意图。请你写出由二氧化硫生成石膏主要成分的化学反应方程式:
(1)_____________________________________,
(2)_____________________________________。

参考答案:(1)CaCO3+SO2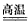 CaSO3+CO2
CaSO3+CO2
(2)2CaSO3+O2 2CaSO4
2CaSO4
本题解析:
本题难度:一般