1、选择题 下列化学用语的表述不正确的是
A.过氧化氢的结构式:H—O—O—H
B.2,2-二甲基丁烷的实验式:C3H7
C.质子数与中子数相等的氢原子符号: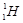
D.Cl-的结构示意图: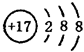
参考答案:C
本题解析:质子数与中子数相等的氢原子符号:21H,所以C错误。
本题难度:一般
2、简答题 氨气和氧气在催化剂存在下的反应方程式为4NH3+5O2
4NO+6H2O完成下列计算:
(1)生成2mol NO消耗氧气的体积为______L(标准状况).
(2)10mol?NH3和10mol O2反应生成8mol NO,过量的氨溶于产物水中成为氨水,计算该氨水中氨的质量分数.
(3)经研究发现,氨氧化生成NO的同时也生成氮气:4NH3+3O2→2N2+6H2O若2mol?NH3和2mol O2恰好完全反应,计算产物气体中NO的物质的量.
参考答案:(1)令参加参加反应的氧气的物质的量为amol,则:
4NH3+5O2=4NO+6H2O
? 5? 4
?amol ?2mol
所以5:4=amol:2mol,解得a=2.5mol,
故参加反应氧气的体积为2.5mol×22.4L/mol=56L,
故答案为:56;?
(2)令参加反应的氨气为nmol、生成的水为bmol,则:
4NH3+5O2=4NO+6H2O
4? 4? 6
nmol? 8mol? bmol
所以4:4=nmol:8mol,解得n=8,
4:6=8mol:bmol,解得b=12mol,
故属于氨气为10mol-8mol=2mol,
所得氨水的质量分数为2mol×17g/mol2mol×17g/mol+12mol×18g/mol×100%=13.6%
答:所得氨水质量分数为13.6%;
(3)令气体中NO、N2的物质的量分别为xmol、ymol,
根据氮原子守恒有:x+2y=2
根据电子转移守恒有:5x+6y=8
联立解得:x=1,y=0.5,
答:产物气体中NO的物质的量为1mol.
本题解析:
本题难度:一般
3、选择题 设nA为阿伏加德罗常数的数值,下列说法正确的是
A.铁与足量稀硝酸反应,1mo1Fe失去电子数为3nA
B.常温常压下,22.4L乙烯中含极性共价键数目为5nA
C.1L1mol?L—1的NH4Cl溶液中有nA个NH4+
D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下充分反应生成H2O个数为nA
参考答案:A
本题解析:A、Fe被足量稀硝酸氧化为Fe3+,正确;B、常温常压下Vm>22.4L/mol,由V/Vm可知n(CH2=CH2)<1mol,所含极性共价键小于4mol,错误;C、由c?V可知n(NH4Cl)=1mol,由于水解,NH4+小于1mol,错误;D、乙酸和乙醇变为乙酸乙酯和水的反应时可逆反应,则水小于1mol,错误。
本题难度:一般
4、简答题 往90mL含16g?CuSO4溶质的溶液中加入2.8g?Fe粉,反应结束后向溶液中加入一定量水,使溶液的体积变为100mL.试计算:
(1)反应得到的固体的质量是多少?
(2)溶液中含有多少克FeSO4?
(3)此时溶液中Fe2+、Cu2+离子的物质的量浓度各是多少?
参考答案:(1)设16g硫酸铜完全反应需要Fe的质量为m,则:
Fe+CuSO4=FeSO4+Cu
56? 160
m? 16g
所以m=5.6g>2.8g,故Fe不足,
设Fe完全反应后,生成Cu的质量ng,则:
Fe+CuSO4=FeSO4+Cu?
56?64
2.8g?ng
故56:64=2.8g:ng,解得n=3.2
答:反应得到的固体的质量是3.2g.
(2)令生成的硫酸亚铁的质量为ag,则:
Fe+CuSO4=FeSO4+Cu?
56?152
2.8g?ag
故56:152=2.8g:ag,解得a=7.6
答:溶液中利用硫酸亚铁的质量是7.6.
(3)2.8gFe的物质的量=2.8g56g.mol=0.05mol,则Fe2+离子的物质的量浓度=0.05mol0.1L=0.5mol/L,
参加反应的硫酸铜为0.05mol,溶液中Cu2+离子的物质的量=16g160g/mol-0.05mol=0.05mol,故Cu2+离子的物质的量浓度=0.05mol0.1L=0.5mol/L,
答:溶液中Fe2+、Cu2+离子的物质的量浓度各是0.5mol/L、0.5mol/L.
本题解析:
本题难度:一般
5、选择题 2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:( )
①2MoS2+7O2=(高温)2MoO3+4SO2; ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl; ④H2MoO4=(△)MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排入空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量比为3:3:2