1、选择题 46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与足量的水反应放出气体的体积是(标准状况下)
A.44.8L
B.11.2L
C.22.4L
D.5.6L
参考答案:B
本题解析:46g钠是2mol,生成1mol Na2O2,过氧化钠和水反应生成0.5mol氧气,标准状况下的体积是11.2L,答案选B。
本题难度:一般
2、选择题 某化合物的化学式为C4H9Cl,它的可能的结构有几种
A.2
B.3
C.4
D.5
参考答案:C
本题解析:
本题难度:一般
3、选择题 含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3―,通入SO2气体
B.Ca2+、Cl―、K+、H+,通入CO2气体
C.Al(OH)4-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I―、HS―,加入AlCl3溶液
参考答案:B
本题解析:A中通入二氧化硫气体发生氧化还原反应:2H2O+ 2NO3―+ 3SO2= 3SO42-+2NO↑+4H+、2H2O+2Fe3++SO2=2Fe2++ SO42-+4H+,生成的SO42-与Ba2+形成沉淀,A错误;C中通过量二氧化碳气体发生反应Al(OH)4-+ CO2=Al(OH)3↓+HCO3-,离子不能大量共存,C错误;D中加入过量氯化铝溶液发生反应3HCO3-+Al3+= Al(OH)3↓+3CO2↑、Al3++ 3HS―+3H2O= Al(OH)3↓+3H2S↑,离子不能大量共存。
考点:离子共存
点评:二氧化硫具有强还原性,能与许多氧化剂(如Fe3+、HNO3、酸性高锰酸钾溶液、双氧水等)反应。
本题难度:简单
4、填空题 碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为 。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
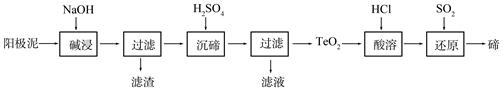
①“碱浸”时TeO2发生反应的化学方程式为 。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀不完全,原因是 ;防止局部酸度过大的操作方法是 。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是 &# 160; 。
参考答案:(1)Zn-2e-=Zn2+ Cu-2e-=Cu2+ (共4分,各2分)
(2)① TeO2+2NaOH=Na2TeO3+H2O (3分)
②TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。(3分)
缓慢加入H2SO4,并不断搅拌 (3分)
③ TeCl4 + 2SO2 + 4H2O="Te" + 4HCl + 2H2SO4 (3分)
本题解析:(1)电解精炼粗铜时,粗铜中的Cu和少量Zn在阳极发生氧化反应,Zn比Cu活泼,先失电子,所以阳极电极反应式为Zn-2e-=Zn2+ Cu-2e-=Cu2+
(2)①TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,化学方程式为TeO2+2NaOH=Na2TeO3+H2O;
②因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。防止局部酸度过大的操作方法是缓慢加入H2SO4,并不断搅拌;
③SO2还原TeCl4为Te,本身被氧化为硫酸,化学方程式为TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4
考点:考查粗铜精炼的电解反应式的书写,对给定条件的化学方程式的判断及书写,实验操作的判断
本题难度:困难
5、选择题 下列两种物质不属于同分异构体的是
A.葡萄糖 ?果糖
B.蔗糖 ?麦芽糖
C.正丁烷 ?异丁烷
D.淀粉 ?纤维素
参考答案:D
本题解析:D.淀粉和纤维素虽然化学式相同,但聚合度不同,严格意义上讲,化学式不同,不能称作同分异构。
本题难度:困难