1、选择题 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。
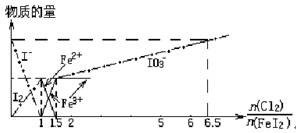
下列结论错误的是(?)
A.Cl2、I2、IO3-、Fe3+的氧化性依次减小
B.当n(Cl2)/n(FeI2)=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-)/n(IO3-)=6.5
D.若溶液的体积不变,则溶液的pH减小
参考答案:A
本题解析:略
本题难度:一般
2、选择题 下列酸的酸酐中,不能由单质和氧气直接反应制得的是(?)
A.HNO3
B.H2CO3
C.H2SO3
D.H3PO4
参考答案:A
本题解析:氮气和氧气反应生成的一氧化氮气体,不是硝酸的酸酐。
本题难度:一般
3、选择题 硫酸铵在强热条件下分解,生成氨气、二氧化硫、氮气和水,反应生成的氧化产物和还原产物的分子之比是
[? ]
A.1:3
B.2:3
C.1:1
D.4:3
参考答案:A
本题解析:解:该反应中,NH4+→N2,氮元素的化合价由-3价→0价,失电子化合价升高,硫酸铵是还原剂,氮气是氧化产物,一个铵根离子失去3个电子;SO42-→SO2,硫元素的化合价由+6价→+4价,得电子化合价降低,硫酸铵是氧化剂,二氧化硫是还原产物,一个硫酸根离子得到2个电子,其最小公倍数是6,其它元素根据原子守恒配平该方程式,方程式为
3(NH4)2SO4=4NH3↑+3SO2↑+N2↑+6H2O,所以氧化产物和还原产物的物质的量之比=1:3.
故选:A.
本题难度:简单
4、选择题 在一定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+ 2Zn=ZnCl2+ZnI2?②ICl+H2O=HCl+HIO。下列叙述正确的是?
[? ]
A.Cl2与I2生成ICl是非氧化还原反应 ?
B.反应①中,ZnI2只是氧化产物 ?
C.反应①中,当转移0.4?mol电子时生成13.6?g?ZnCl2 ?
D.反应②中,ICl既是氧化剂又是还原剂
参考答案:C
本题解析:
本题难度:简单
5、选择题 稀土元素是宝贵的战略资源.我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素.在稀土混合溶液中加人H2O2,调节 转变为
转变为 沉淀得以分离。其反应的化学方程式可表示为
沉淀得以分离。其反应的化学方程式可表示为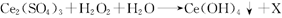 (未配平)。下列对该反应的说法不正确的是
(未配平)。下列对该反应的说法不正确的是
A.X为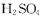
B.H2O2为氧化剂
C.该反应属于非氧化还原反应
D.该反应中每生成52g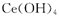 ,转移电子的物质的量为0. 25 mol
,转移电子的物质的量为0. 25 mol
参考答案:C
本题解析:A正确,根据质量守恒定律得X为H2SO4;B正确,在反应中过氧化氢中O元素的化合价降低,为氧化剂;C错,由于在反应中出现了元素的化合价升降,所以该反应为氧化还原反应;D正确,根据氧化还原反应中得失电子数相等可得,每生成52g ,转移电子的物质的量为0. 25 mol
,转移电子的物质的量为0. 25 mol
本题难度:一般