1、选择题 若氯的同位素有35Cl、37Cl,氢的同位素有1H、2H、3H,则从HCl分子的原子组成来看,HCl分子一共有
A.3种
B.6种
C.9种
D.12种
参考答案:B
本题解析:可组成1H 35Cl、1H 37Cl、2H 35Cl、2H 37Cl、3H 35Cl、3H 37Cl六种氯化氢分子
本题难度:简单
2、推断题 具有相同电子层结构的A、B两种离子,可组成AB型离子化合物。A、B的单质在常温时都可与水剧烈反应。试推断: ?
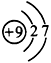
(1)A离子的结构示意图________;B原子的结构示意图___________。 ?
(2)A单质与水反应的离子方程式为__________________。 ?
(3)B单质与水反应的化学方程式为__________________。
参考答案:(1)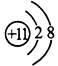 ;
;
(2)2Na+2H2O=2Na++2OH-+H2↑?
(3)2F2+2H2O=4HF+O2
本题解析:
本题难度:一般
3、选择题 N、O、Si、S是重要的非金属元素,下列说法正确的是( )
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2
参考答案:A.同周期自左而右原子半径减小,故原子半径N>O,Si>S,同周期自左而右非金属性增强,故非金属性N<O,Si<S,故A错误;
B.氮的氧化物和硫的氧化物都是形成酸雨的主要物质,形成光化学烟雾的物质是氮的氧化物,故B错误;
C.SO2、SiO2属于酸性氧化物,能与NaOH反应生成相应的盐与水,SO2与氢硫酸、硝酸、次氯酸等反应,SiO2与氢氟酸反应,S与氢氧化钠溶液反应生成硫化钠、亚硫酸钠与水,Si与氢氧化钠溶液反应生成硅酸钠与氢气,故C正确;
D.Si和氧气反应生成SiO2,硫与氧气反应生成SO2,但氮气与氧气反应生成NO,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 实际存在的11H、12H、13H、H+和H2,它们是( )
A.氢的五种同位素
B.五种氢元素
C.氢的五种核素
D.氢元素的五种不同微粒
参考答案:A、同位素是原子而言的,H2为单质,故A错误;
B、元素为质子数相同中子数不同一类原子的总称,是氢元素的形成不同微粒,故B错误.
C、核素是指具体的原子,H2为单质,故C错误.
D、是氢元素的形成不同微粒,故D正确.
故选:D
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是( )
A.离子化合物的熔点一定比共价化合物的熔点高
B.同一主族的两种元素的原子序数之差可能为16
C.IA族元素形成的单质的熔点随原子序数的递增而降低
D.同一短周期元素的离子半径从左到右一定增大
参考答案:A.离子化合物的熔点不一定比共价化合物的熔点高,如二氧化硅为原子晶体,其熔点大于NaCl的熔点(离子晶体),故A错误;
B.同一主族的两种元素的原子序数之差为2、8、8、18、18、32等,不可能为16,故B错误;
C.IA族元素形成的单质为金属晶体(H除外),随原子序数增大半径增大,则金属键减弱,熔点减小,故C正确;
D.同一短周期元素的离子半径从左到右先减小后增大,如第三周期中铝离子的半径最小,故D错误;
故选C.
本题解析:
本题难度:简单