1、选择题 已知反应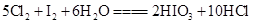 ,
,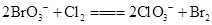 ,下列物质氧化性强弱顺序正确的是(?)
,下列物质氧化性强弱顺序正确的是(?)
A.
B.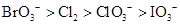
C.
D.
参考答案:C
本题解析:根据氧化还原反应的规律,氧化性的比较顺序为:氧化剂>氧化产物>还原产物>还原剂。则可以找到氧化性的比较:BrO3-> ClO3->Cl2> ClO3->I2
点评:本题属于常见题型,涉及到了氧化性强弱的比较,只要抓住氧化性比较顺序的规律就可以得到正确答案。
本题难度:简单
2、选择题 根据下列反应(1)Cl2+ 2KBr==2KCl+ Br2,(2)Br2 + 2KI==2KBr +I2,判断单质的氧化性由强到弱的顺序是(?)
A.Br2> I2> Cl2
B.Cl2> Br2> I2
C.Cl2> I2> Br2
D.Br2> Cl2> I2
参考答案:B
本题解析:氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,即. Cl2> Br2、Br2> I2,故答案为B
本题难度:简单
3、填空题 已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应氧化产物的物质的量分别是________________。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82—+2I-=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:______________________________、____________________________(不必配平)。
参考答案:(1)I-、Fe2+ 2 mol、2 mol
(2)I-、Fe2+、Br- 1 mol、3 mol、0.5 mol
(3)2Fe3++2I-=2Fe2++I2 S2O82—+2Fe2+=2SO42—+2Fe3+
本题解析:根据题意,各粒子的氧化性、还原性顺序为:氧化性:Cl2>Br2>Fe3+>I2,还原性:I->Fe2+>Br->Cl-。
(1)n(I-)=1 mol×2=2 mol,n(Br-)=2 mol×2=4 mol,n(Fe2+)=1 mol+2 mol=3 mol。
通入2 mol Cl2时,先氧化I-,后氧化Fe2+
Cl2 + 2I-=I2+2Cl-
1 mol? 2 mol
Cl2 + 2Fe2+=2Fe3++2Cl-
1 mol? 2 mol
剩余1 mol Fe2+,故Br-不可能被氧化。
(2)通入3 mol时,氧化2 mol I-需1 mol Cl2,氧化3 mol Fe2+需1.5 mol Cl2,还有0.5 mol Cl2可氧化1 mol Br-,故对应的氧化产物的物质的量分别是1 mol、3 mol、0.5 mol。
(3)此题要从催化剂的本质出发,作为催化剂的物质要参与有关反应,但后来的反应必须又生成了催化剂。本题要求写出表示Fe3+作催化剂的反应,因此,首先Fe3+要参与反应,即有反应2Fe3++2I-=2Fe2++I2,生成的Fe2+又被S2O32—氧化生成了Fe3+,即S2O82—+2Fe2+=2SO42—+2Fe3+
本题难度:一般
4、选择题 下列装置或操作不能达到实验目的是( )
A.

比较Cl2、Fe3+、I2的氧化性
B.
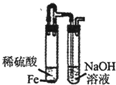
制取Fe(OH)2
C.
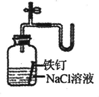
证明铁生锈时空气参加反应
D.
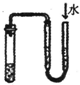
检查装置气密性
参考答案:A、依据图中的操作,通入氯气会先和碘离子反应生成碘单质,然后再氧化亚铁离子生成三价铁离子,碘离子的还原性大于二价铁离子,说明三价铁离子的氧化性比碘单质强,可以比较氯气和Fe3+,氯气和I2的氧化性,故A能达到目的;
B、装置中铁和稀硫酸反应生成了硫酸亚铁和氢气,由于氢氧化亚铁很易被空气中的氧气氧化看不到白色沉淀的生成,所以必须先排净试管内的空气,在使硫酸亚铁和氢氧化钠反应,装置中盛硫酸的试管中导气管为伸入溶液,硫酸亚铁无法压入后面的试管与氢氧化钠反应,所以达不到实验目的,故B不能达到目的;
C、铁生锈要有空气和一定的湿度才行,在水里和盐溶液里面除了满足上述两个条件以外,还有加速铁生锈的另一个重要因素电解质,由于电解质的存在会大大加快生锈的速度,含量越高就越快,这也是在盐水里面生锈最快的原因.食盐水是电解质,电解质加速铁生锈的速度,根据右面红墨水液面的变化可证明铁生锈空气参与反应,故C能达到目的;
D、检查装置气密性可以采取“注水法”:首先关闭排气导管,从顶部漏斗口注水,当漏斗下端被水封闭后再注水,水面不下降,表明装置气密性好;如果水面下降,表明装置气密性差,故D能达到目的;
故选B.
本题解析:
本题难度:一般
5、选择题 Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.已知Co2O3在酸性溶液中易被还原成Co2+,下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2→2FeCl3+4FeI3
B.Cl2+FeI2→FeCl2+I2
C.Co2O3+6HCl→2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-→2Fe2++I2
参考答案:A、根据反应:3Cl2+6FeI2=2FeCl3+4FeI3,得出氧化性是:Cl2>FeCl3,但是氧化性是FeCl3>I2,还原性是碘离子强于亚铁离子,碘离子会先被氯气氧化,和题意不相符合,不可能发生,故A正确;
B、根据反应:Cl2+FeI2=FeCl2+I2,得出氧化性是:Cl2>I2,和题意相符合,反应可能发生,故B错误;
C、根据反应:Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,得出氧化性是:Co2O3>Cl2,和题意相符合,反应可能发生,故C错误;
D、根据反应:2Fe3++2I-=2Fe2++I2,得出氧化性是:FeCl3>I2,和题意相符合,反应可能发生,故D错误.
故选A.
本题解析:
本题难度:简单