1、选择题 下列叙述正确的是( )
A.所有分子中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力大小有关
C.第VIA族元素的气态氢化物H2O、H2S、H2Se的熔沸点依次升高
D.只要是离子化合物,其中就一定还有金属元素
参考答案:B
本题解析:
本题难度:一般
2、填空题 下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:?。
元素C、D、E、F的第一电离能由大到小的顺序是?(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有?。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为?。
②该化合物的晶体中存在的作用力有?。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为?。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是?。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是?。
参考答案:(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1)?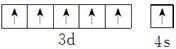 ?F>N>O>C
?F>N>O>C
(2)CD
(3)①分子晶体 ②BDF ③1∶2
(4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n
(5)Be与Al在元素周期表中位于对角线的位置
本题解析:根据这几种元素在周期表中的位置推知:A为H(氢),B为Be,C为C(碳),D为N,E为O,F为F(氟),G为Al,H为Cl,I为Cr,J为Fe,(1)Cr元素基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其价层电子排布图为 ,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能, 91ExAM.org因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能, 91ExAM.org因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
本题难度:一般
3、选择题 关于键长、键能和键角,下列说法不正确的是( )
A.键角的大小与键长、键能的大小无关
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越长,共价化合物越稳定
D.键角是描述分子立体结构的重要参数
参考答案:C
本题解析:
本题难度:一般
4、填空题 物质的组成、结构和反应条件对物质的性能和用途有很大的影响.
(1)提高玻璃中______的含量或加入B2O3能提高玻璃的化学稳定性和降低其热膨胀系数;加入氧化亚铜,玻璃呈______色;
(2)工业上常用硫与橡胶分子作用使橡胶硫化,硫的作用是______.
参考答案:(1)调整的化学组成可以制成不同性能和用途的玻璃;提高玻璃中SiO2的含量或加入B2O3能提高玻璃的化学稳定性和降低其热膨胀系数;氧化亚铜为红色,加入氧化亚铜,玻璃呈红色,
故答案为:SiO2;红色;
(2)天然橡胶是线性结构强度和韧性差,用S和橡胶作用,使橡胶硫化变成体型结构,让其具有较高的强度、韧性和化学稳定性,
故答案为:使天然橡胶的线性结构变成体型结构.
本题解析:
本题难度:一般
5、填空题 请回答以下问题:
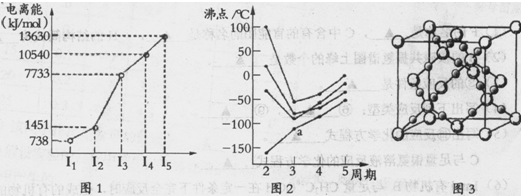
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为?.
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是?.简述你的判断依据?.
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于?(选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为?。
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为?.
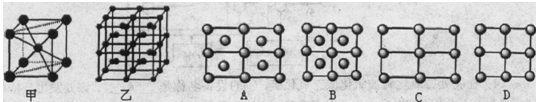
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是?.铁原子的配位数是?,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为?(设阿伏加德罗常数的值为NA)。
参考答案:(1)3s23p6(2分)
(2)SiH4 (1分);在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,a点所在折线对应的是气态氢化物SiH4(2分)
(3)原子(1分) ;?sp3杂化(2分)
(4)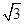 (1+b):
(1+b):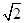 (1+a)?(2分)
(1+a)?(2分)
(5)A (2分);?8 (1分);? ?(2分)
?(2分)
本题解析:(1)该元素第三电离能远远大于第二电离能,说明该元素的原子价电子数为2,为Ca,M层电子排布式为:3s23p6
(2)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,第ⅣA族形成的氢化物分之间为范德华力,组成与结构相似,相对分子量越大,范德华力越大,沸点越高,所以a点所在折线对应的是气态氢化物SiH4。
(3)由CO2在高温高压下所形成的晶体图可以看出,其晶体结构为空间物质结构,每个C原子周围通过共价键连接4个O原子,所以该晶体为原子晶体,碳原子轨道的杂化类型为sp3杂化。
(4)设Cl?半径为r,则Na+半径为ar,Cs+半径为br,NaCl晶胞边长为x,因为NaCl晶胞为面心立方结构,所以2x2=(2r+2ar)2,得r= 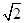 (1+a)r;CsCl晶胞为体心李立方结构,所以y2+2y2=(2r+2br)2,可得y=2/
(1+a)r;CsCl晶胞为体心李立方结构,所以y2+2y2=(2r+2br)2,可得y=2/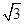 (1+b)r,x:y=
(1+b)r,x:y=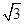 (1+b):
(1+b):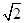 (1+a)
(1+a)
(5)甲中Fe位于顶点和体心,乙由8个甲组成,按甲虚线方向切乙形成的纵截面边长不相等,则排除B、D,由于每个小晶胞中的体心含有1个Fe原子,则应为A;由图甲可以看出,位于体心的铁原子周围距离最近的铁原子有8个,所以铁原子的配位数是8;设图甲晶胞的边长为acm,则a2+2 a2=(4r)2,得a=4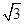 /3r ,图甲晶胞的体积V=a3=64
/3r ,图甲晶胞的体积V=a3=64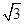 /9r3,根据均摊发可知甲中晶胞含Fe原子:8×1/8+1=2,设Fe的相对原子质量为M,则64
/9r3,根据均摊发可知甲中晶胞含Fe原子:8×1/8+1=2,设Fe的相对原子质量为M,则64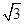 /9r3?ρ="2M/" NA,M=
/9r3?ρ="2M/" NA,M=
本题难度:困难