1、选择题 在恒温恒容的密闭容器中,发生反应3A(g)+B(g)
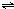
xC(g).
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a.下列说法正确的是( )
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B)=n(A)+3
D.若Ⅱ体系起始物质的量当满足3n(C)+8n(A)═12n(B)时,可判断x=4
参考答案:A.由于x值不确定,则若Ⅰ达平衡时,A、B、C各增加1mol,B的转化率不能确定,故A错误;
B.因容器体积不变,若x=4时,C的体积分数应为a,现大于a,x应小于4,促进平衡正向移动,故B错误;
C.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+3xn(C)=3,n(B)+1xn(C)=2,若x=2,二者联式可得3n(B)=n(A)+3,故C正确;
D.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+3xn(C)=3,n(B)+1xn(C)=2,若x=4,二者联式可得3n(C)+8n(A)═12n(B),故D正确.
故选CD.
本题解析:
本题难度:一般
2、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  ?2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
?2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质的物质的量/mol[]
| 平衡时反应中的能量变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量a kJ
|
②
| 2
| 3
| 0
| 放出热量b kJ
|
③
| 2
| 6
| 0
| 放出热量c kJ
|
下列叙述正确的是?
A.反应的平衡常数:③>①>②? B.达到平衡时氨气的体积分数:①>③
C.放出的热量(kJ):a<b<92.4? D.反应得到1mol NH3(l),放出热量46.2kJ
参考答案:C
本题解析:平衡常数只与温度有关系,所以三个容器中的平衡常数相同,A不正确。③相当于在①的基础上缩小容器的弱碱,平衡向正反应方向移动,所以达到平衡时氨气的体积分数是③>①,B不正确。反应是可逆反应,所以①②中不可能生成1mol氨气。②增大氢气的浓度,通过氮气的转化率,所以选项C正确。生成1mol氨气时放热46.2kJ,而不是液氨,D不正确。答案选C。
本题难度:一般
3、选择题 在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g)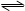 N2O4(g),△H<0,若把烧瓶置于100℃的沸水中,下列物理量没有发生改变的是:①颜色;②平均相对分子质量;③质量;④压强;⑤密度?
N2O4(g),△H<0,若把烧瓶置于100℃的沸水中,下列物理量没有发生改变的是:①颜色;②平均相对分子质量;③质量;④压强;⑤密度?
A.③⑤
B.③④
C.②④
D.①③
参考答案:A
本题解析:在恒容的条件下,反应体系的温度升高,平衡向吸热方向即逆向移动,红棕色的NO2气体的浓度增大,体系颜色加深;气体的总物质的量增大;平均相对分子质量减小;压强增大;气体的总质量不变,故密度不变,答案为A
本题难度:一般
4、计算题 (本 题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
t
c?
| 初始
| 2min
| 4min
| 6min
| 8min
|
c(A)( mol·L -1)
| 2.50
| 2.20
| 2.00
| 2.00
| 2.20
|
c(B)( mol·L -1)
| 1.56
| 2.16
| 2.56
| 2.56
| 2.16
|
c(C)( mol·L -1)
| 0.39
| 0.54
| 0.64
| 0.64
| 1.54
|
请填空:
(1)前2mim内,v(B)= ?。
(2) 到2mim末A 的转化率为?。
(3)该反应的化学方程式为?。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为?(填选项字母)
a.增大A的浓度? b.减小B的浓度? c.增大C的浓度
则该物质的浓度改变量为?mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则?是原来的2倍。
a. A的转化率?b. B的平衡浓度?表? c.达到平衡的时间? d.平衡时气体的密度
参考答案:(本题共12分,每空2分)(1)? 0.30mol/L.min? (2)? 12%
(3)? 2A 4B+C? (4)? c? ;? 1.0? mol·L -1?(5) d
4B+C? (4)? c? ;? 1.0? mol·L -1?(5) d
本题解析:(1)根据表中数据可知,前2min内B的浓度增加了2.16mol.L-1.56mol/L=0.6mol/L,所以反应速率是0.6mol/L÷2min=0.3mol/(L·min)。
(2)2min末时A的浓度降低了0.30mol/L,所以A的转化率是0.30÷2.50×100%=12%。
(3)C的浓度增加了0.15mol/L,所以根据变化量之比是相应的化学计量数之比可知,反应的方程式是2A 4B+C。
4B+C。
(4)6 min~8 min时,A、C的浓度增加,B的浓度降低,所以改变的条件是增大了C的浓度,答案选c。
(5)温度不变,平衡常数不变;若开始加入的三种物质的物质的量浓度是原来的2倍,则相当于增大压强,平衡向逆反应方向进行,所以bc不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密度是原来的2倍。
本题难度:一般
5、选择题 某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g)  Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
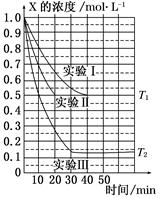
A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂
B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应
C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同
D.若起始浓度c(X)=0.8 mol·L-1,c(Y)=c(W)=0,其余条件与实验Ⅰ相同,则平衡浓度c(X)=0.4 mol·L-1
参考答案:C
本题解析:起始浓度相同,实验Ⅱ反应进行快,实验Ⅱ可能使用了催化剂;实验Ⅰ与实验Ⅲ相比,实验Ⅲ温度T1<T2,X的浓度降低,说明平衡左移,该反应是吸热反应;在实验Ⅰ、Ⅱ、中,达到平衡状态时X的体积百分含量相同,Ⅲ不同。
本题难度:一般