1、选择题 在周期表中金属和非金属的分界线附近能找到
A.制农药的元素
B.制催化剂的元素
C.做半导体的元素
D.制耐高温合金材料的元素
参考答案:C
本题解析:周期表中金属和非金属的分界线附近的元素往往既难失去电子,也难得到电子,一般常用作半导体材料。A是在非金属元素中寻找,B和D在过渡元素中寻找。答案选C。
本题难度:简单
2、填空题 写出下列物质的电子式:(每小题1分,共4分)
(1)?硫化氢:??氧气:???
(2)?氯化铵:??过氧化钠:?
参考答案:(1)?略? ?(2)?O2?
?(2)?O2?
(3)?氯化铵??(4)?Na+[: 0: 0:]2-Na+
本题解析:略
本题难度:一般
3、选择题 有A、B、C三种短周期元素,质子数之和为31。若C为Ar,则关于A、B两种元素的说法中正确的是
A.如果A是金属元素,则B一定是稀有气体元素
B.如果A元素是氟,则B元素是硼
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
D.如果A的最高正价是+3,则B的单质有两种常见的同素异形体
参考答案:D
本题解析:由题意知A、B质子数之和为13,A、B质子数均小于13。A、A可能为Li、Na、Mg,对应B分别为Ne、He、H,错误;B、A元素是氟,则B为4号元素为铍,错误;C、气态氢化物的水溶液显碱性的物质为氨气,则A为氮元素,B 为碳元素,其气态氢化物均不溶于水,错误;D、最高正价是+3的元素为硼,则B为O元素,有O2、O3两种同素异形体,正确。
本题难度:一般
4、选择题 甲、乙两种金属性质比较:①甲的单质熔、沸点比乙的低;②常温下,甲能与水反应放出氢气而乙不能;③最高价氧化物对应的水化物碱性比较,乙比甲的强;④以铂作电极,含甲、乙离子的盐溶液作电解液电解,乙先析出;⑤甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡。上述项目中能够说明甲比乙的金属性强的是
A.①②⑤
B.②④⑤
C.②③⑤
D.②③④
参考答案:B
本题解析:考查金属性强弱比较。金属性越强和水或酸反应的就越剧烈,就越容易置换出氢气。最高价氧化物对应水化物的解析就越强,但相应金属阳离子的氧化性就越弱。在原电池中较活泼的金属一般作负极,不活泼的金属一般作正极。活泼的金属可以把不活泼的金属从其盐溶液中置换出来。金属性强弱和单质的熔沸点高低无关,所以答案是B。
本题难度:一般
5、填空题 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是?(用元素符号表示)
(2)A、B、C为同一短周期金属元素。依据下表数据分析,C元素在化合物中的主要化合价为?;第二电离能(I2)B小于A的原因是?。
电离能/kJ·mol-1
| I1
| I2
| I3
| I4
|
A
| 500
| 4600
| 6900
| 9500
|
B
| 740
| 1500
| 7700
| 10500
|
C
| 580
| 1800
| 2700
| 11600
|
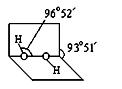
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取?杂化;通常情况下,H2O2与水任意比互溶的主要原因是?。
(4)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+ 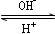 ?R(OH)3
?R(OH)3 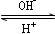 ?[R(OH)4]-
?[R(OH)4]-
①基态R原子的价电子排布式为?。
②[R(OH)4]-中存在的化学键是?。
A.离子键? B.极性键 ? C.非极性键?D.配位键
? C.非极性键?D.配位键
参考答案:(1)F>Cl>S ?(2分)
(2)+3?(1分)
A+外层电子排布为2s22p6稳定结构,难再失去一个电子。B+外层
电子排布为3s1,易失去一个电子。(其他合理答案也给分)?(2分)
(3)sp3?(2分)
H2O2分子与水分子间形成氢键?(2分)
(4)①3d54s1?(2分)
②BD?(2分)
本题解析:略
本题难度:简单