1、选择题 在5 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的
2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的 ,则A的转化率为
,则A的转化率为
A.67%
B.50%
C.25%
D.5%
参考答案:
B
本题解析:
同温度同体积时,气体的物质的量之比等于压强之比,故反应后的物质的量为
(2+1) mol× ="2.5" mol,再由差量法可知反应掉的A为1 mol,即A转化率为
="2.5" mol,再由差量法可知反应掉的A为1 mol,即A转化率为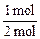 ×
×
100%=50%。
本题难度:一般
2、填空题 (12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
t℃
| 700
| 800
| 850
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
请回答:
(1)上述反应中Q?0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是?。
a. 容器中压强不变? b. 反应热不变? c. v正(H2) =v逆(CO)? d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
时间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c 2
| c 3
| c 3
|
4
| c 1
| c 2
| c 3
| c 3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
|
①计算:3 min时CO的浓度c 1 =?mol/L,H2O (g)的转化率=?。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是?表中5min~6min之间数值发生变化,可能的原因是?
a . 增加水蒸气? b. 降低温度? c. 使用催化剂? d. 增加氢气浓度
参考答案:(1)>? (2)? c d? (3) 0.08? 40%? (4) d? a
本题解析:(1)由表中数据,随温度的升高,K增大,即该反应的正反应方向为吸热反应,Q>0;
(2)能判断该反应已达到化学平衡状态的依据是:cd;a错,该反应为等体积反应,无论平衡与否容器内压强不变;b错,对于某一具体的反应来说,反应热为一常数;
(3)①3 min时该反应已达平衡则,
由化学反应方程式CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.200? 0.300? 0? 0
变化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)0.2—x? 0.3—x? x? x
850℃时该反应的平衡常数 ,解得x=0.12;
,解得x=0.12;
即可得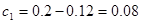 ;H2O (g)的转化率
;H2O (g)的转化率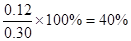 ;
;
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是增加氢气浓度,表中5min~6min之间数值发生变化,可能的原因是增加水蒸气;
本题难度:一般
3、选择题 相同温度下,在体积相等的二个恒容密闭容器中发生可逆反应:
N2 (g)+3H2(g) 2NH3(g)△H=" —92.4" kJ/mol。
2NH3(g)△H=" —92.4" kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质物质的量/mol
| 达平衡时反应中的能量变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量a kJ
|
②
| 2
| 6
| 0
| 放出热量bkJ?
|
下列叙述正确的是(?)
A.放出热量关系:b>2a? B.放出热量关系:b =2a
C.达平衡时氨气的体积分数:①>②? D.N2的转化率:①<②
参考答案:AD
本题解析:容器②相当于在容器①的基础上增大压强,平衡向逆反应方向移动,所以容器②中反应物的转化率高,因此A、D正确,BC是错误的,答案选AD。
本题难度:一般
4、选择题 可逆反应2SO2+O2 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是
①v(SO2)=v′(SO2)
②v(O2)=v′(SO2)=v(SO3)
③v(O2)= v′(SO2)
v′(SO2)
④v′(SO2)=v′(O2)=v′(SO3)
A.①②③④
B.①②③
C.②③④
D.①③
参考答案:D
本题解析:根据化学反应速率判断一个反应是否达到化学平衡的标志是:v正=v逆。对于反应2SO2(g)+O2(g) 2SO3(g)达到化学平衡时,v(SO2)=2v(O2)=v(SO3)=v′(SO2)=2v′(O2)=v′(SO3)。
2SO3(g)达到化学平衡时,v(SO2)=2v(O2)=v(SO3)=v′(SO2)=2v′(O2)=v′(SO3)。
本题难度:一般
5、选择题 一定温度下,某密闭容器中存在可逆反应:X Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是(? )
Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是(? )

A.X在该条件下一定不为气体
B.Y和Z在该条件下至少有一种为气体
C.t1时刻达到平衡时和t3时刻平衡时,气态物质的浓度相同
D.由t1~t3,平衡并未发生移动。
参考答案:D
本题解析:根据图像可知,增大压强,正反应速率不变,逆反应速率增大这说明反应物中没有气体,生成物中含有气体。由于两次的平衡中反应速率是相同的,所以气态物质的浓度相同。根据图像可知,平衡向逆反应方向移动,所以选项D是错误的,其余都正确。答案选D。
本题难度:一般