| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《水的电离平衡》试题强化练习(2019年最新版)(二)
参考答案:AB 本题解析:醋酸溶液中带电离子只有H+、CH3COO-、OH-,由电荷守恒原理可知,c(H+)= c(CH3COO-)+c(OH-),故A正确;硫酸和醋酸分别是强酸、弱酸,溶质浓度相同时溶液pH:硫酸<醋酸,而溶液pH相同时溶质浓度:硫酸<<醋酸,则pH和体积都相同时溶质的物质的量:硫酸<<醋酸,则醋酸消耗NaOH的量远远大于硫酸,故B正确;NaOH、Ca(OH)2分别是一元强碱、二元强碱,同温同浓度溶液中c(OH-):NaOH<Ca(OH)2,强碱电离产生的c(OH-)越大,水的电离平衡(H2O 本题难度:简单 2、选择题 运用相关化学知识进行判断,下列结论错误的是 |
参考答案:D
本题解析:吸热反应可以自发进行,说明不能用焓变来判断,就用熵来判断,反应自发进行说明是熵增反应,A说法正确;0.1 mol/L氨水电离度α=1%则c(OH-)=10-3mol/L,那么pH为11,B说法正确,用蒸馏水润湿的试纸测溶液的pH,测碱性溶液时结果偏低,测酸性溶液时结果偏高,C说法正确;铁遇到浓硫酸发生钝化,没有H2生成,D错,选D 。
考点:自发反应的判据,弱电解质的电离、基本实验操作和化学反应速率。
本题难度:一般
3、简答题 室温时,等物质的量浓度的四种溶液:①HClO ②NaCl ③HCl ④NaOH中,水的电离程度是否相同?为什么?
参考答案:不同;当物质的量浓度相同时,HCl溶液中的c(H+)与NaOH溶液中的c(OH-)相同,对水的电离平衡的抑制程度相同,故这两种溶液中水的电离程度相同。NH4Cl溶液中,NH4+与OH-结合,c(OH-)降低,平衡正向移动,水的电离程度增大。在NaCl溶液中,Na+与Cl-均不能与水电离的H+、OH-结合形成弱电解质,故水的电离平衡不发生变化。所以,这四种溶液中水的电离程度不同,按水的电离程度由大到小的顺序为:①>②>③=④。
本题解析:
本题难度:一般
4、选择题 pH=2的两种一元酸x和y,体积均为100mL,稀释过程中,pH与溶液体积的关系如右图所示。分别滴加NaOH溶液(c="0.1" mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy,则( )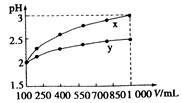
A.x为弱酸,Vx < Vy
B.x为强酸,Vx > Vy
C.y为弱酸,Vx < Vy
D.y为强酸,Vx > Vy
参考答案:C
本题解析:由图可知x为强酸,y为弱酸;在PH相同且体积相同的情况下,弱酸y的物质的量比x多,消耗NaOH的物质的量更多,所以正确选项为C;
本题难度:一般
5、选择题 5.某温度下,满足下列条件的溶液肯定呈酸性的是
A.加酚酞显无色的溶液
B.含有H+的溶液
C.pH<7的溶液
D.CH3COOH和NH3·H2O混合液,当c(CH3COO-)> c(NH4+)时
参考答案:D
本题解析:酸性溶液不能使酚酞变色,且溶液的pH<7,但是加酚酞显无色的溶液不一定是酸性溶液,中性溶液也不能使酚酞变色;含有H+的溶液不一定是酸溶液,H2O电离也会产生H+,但H2O不是酸溶液;pH<7的溶液只有在温度为25℃时才是酸性溶液;CH3COOH和NH3·H2O的混合液,当c(CH3COO-)> c(NH4+)时,说明醋酸过量,溶液显酸性。
考点:溶液酸碱性的判断
点评:要了解酸性溶液的性质,同时也要会判断什么样的溶液是酸性溶液,本题容易出错的选项是C项,不能简单的通过pH的大小来判断溶液的酸碱性。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《原子核外电.. | |