1、选择题 实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于1,0.1 mol/L某一元碱(BOH)溶液里:c(H+)/c(OH-)=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
[? ]
A.c(B+)>c(A-)>c(OH-)>c(H+)
B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(H+)>c(A-)>c(OH-)>c(B+)
D.c(B+)>c(A-)>c(H+)>c(OH-)
参考答案:A
本题解析:
本题难度:一般
2、选择题 物质的量浓度相同时,下列既能跟NaOH溶液反应又能跟盐酸反应的溶液中,pH最大的是
[? ]
A.Na2CO3溶液
B.NH4HCO3溶液
C.NaHCO3溶液
D.NaHSO4溶液
参考答案:C
本题解析:
本题难度:一般
3、选择题 25℃时,某一元酸(HB)的盐NaB的水溶液呈碱性,下列叙述正确的是
[? ]
A.HB的电离方程式为:HB==H++B-
B.NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-)
C.NaB溶液中存在如下关系:c(Na+)+c(H+)==c(HB)+c(B-)
D.0.1mol/L NaB溶液中水电离的OH-浓度大于10-7mol/L
参考答案:D
本题解析:
本题难度:一般
4、填空题 现有25℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中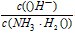 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式__________________;所得溶液的pH_______7(填“<”“>”或“=”), 用离子方程式表示其原因__________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=_____________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
参考答案:(1)减小
(2)NH3·H2O+H+=NH4++H2O;<;NH4++H2O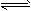 NH3·H2O+H+
NH3·H2O+H+
(3)a/2mol/L
(4)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
本题解析:
本题难度:一般
5、简答题 物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
HClO:Ka=3×10-8,HCN:Ka=4.9×10-10
H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11
(1)84消毒液中通入少量的CO2,该反应的化学方程式为______.
(2)25℃时,等物质的量浓度的①NaClO溶液;②Na2CO3溶液;③NaCN溶液,三溶液的pH由大到小的顺序为______(填序号).
(3)等物质的量NaClO和NaHCO3的混合液中,各微粒浓度的关系为:[Na+]=______+[H2CO3]
(4)实验室可用如图所示装置制备84消毒液,则a为______极,制备过程中总的离子反应方程式为______.
(5)25℃时x?mol?L-1CH3COOH溶液与0.01mol?L-1?NaOH溶液等体积混合,溶液显中性,则[CH3COO-]______[Na+](选填“>”、“<”或“=”),用含x的代数式表示CH3COOH的电离平衡常数Ka=______.
参考答案:(1)由Ka可知碳酸的酸性>HClO,则84消毒液中通入少量的CO2的反应为NaClO+CO2+H2O═HClO+NaHCO3,
故答案为:NaClO+CO2+H2O═HClO+NaHCO3;
(2)等物质的量浓度的盐溶液,酸越弱,则对应盐的水解程度越大,pH就越大,由Ka可知,酸性HClO>HCN>HCO3-,则等物质的量浓度的①NaClO溶液、②Na2CO3溶液、③NaCN溶液,三溶液的pH由大到小的顺序为②>③>①,故答案为:②>③>①;
(3)等物质的量NaClO和NaHCO3的混合液中,由物料守恒可知,n(Na)=n(Cl)+n(C),则[Na+]=[ClO-]+[HClO]+[HCO3-]+[HCO32-]+[H2CO3],
故答案为:[Na+]=[ClO-]+[HClO]+[HCO3-]+[HCO32-];
(4)由图可知,a为负极,b为正极,在下端氯离子放电生成氯气,与上端生成的NaOH溶液反应生成NaClO,总离子反应为Cl-+H2O?电解?.?ClO-+H2↑,
故答案为:负;Cl-+H2O?电解?.?ClO-+H2↑;
(5)根据电荷守恒式为[CH3COO-]+[OH-]=[Na+]+[H+],溶液显中性时[OH-]=[H+],则[CH3COO-]=[Na+],又电离平衡常数Ka=c(CH3COO-)c(H+)c(CH3COOH),c(H+)=10-7mol/L,[CH3COO-]=[Na+]=0.005mol/L,c(CH3COOH)=x2mol/L,则Ka=10-9x-10-2,故答案为:=10-9x-10-2.
本题解析:
本题难度:一般