1、填空题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相?关?信?息
|
X
| X最高价氧化物的水化物与气态氢化物可以形成一种盐
|
Y
| 单质是良好的半导体材料,广泛应用于光电信息领域
|
Z
| Z的一种核素质量数为27,中子数为14
|
W
| 最高价氧化物对应的水化物是一种不溶于水的蓝色固体
|
?
(1)Z位于元素周期表第__________周期第_________族;Z的原子半径比Y的________, X的第一电离能比Y的________(填“大”或“小”)。
(2)W基态原子的核外电子排布式为____?____,XH3分子的沸点较高,请解释其原因____?。
(3)X的氢化物(X2H4)的制备方法之一是将NaClO溶液和XH3反应制得,试写出该反应的离子方程式?。
(4)已知下列数据:4W(s)+ O2(g) = 2W2O(s)?△H =" -337.2" KJ/mol? 2W(s)+ O2(g) = 2WO(s)?△H =" -314.6" KJ/mol;由W2O和O2反应生成WO的热化学方程式是?。
2、选择题 等物质的量的氢气和氦气在同温同压下具有相等的(?)
A.原子数
B.体积
C.电子数
D.质量
3、填空题 元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
元素代号
| A
| B
| C
| D
| E
|
原子半径/nm
| 0.16
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6,-2
| +2
| -2
|
?
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
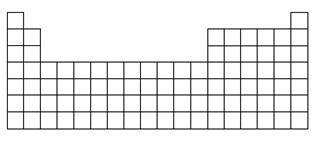
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
4、填空题 (6分)短周期元素ABCD原子序数依次增大。A元素原子核内无中子;B元素原子核外最外层电子数是次外层电子数的2倍;C元素是地壳含量最多的元素;D在短周期元素中金属性最强。请回答:
(1)B在元素周期表中的位置是?。
(2)A与C可形成10电子分子,其化合物类型为?(填“离子”或“共价”)化合物。
(3)A与C还可以形成一种18电子分子,向其溶液中加入少量二氧化锰粉末,反应的化学方程式为?。
(4)D与C按原子个数比为1:1组成的化合物与BC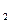 反应的化学方程式为
反应的化学方程式为
?。
5、选择题 下列说法正确的是(? )
A.第ⅠA族元素都是碱金属元素
B.第ⅦA族元素都是卤族元素
C.氟元素在第ⅦA族,最高正化合价为+7,因此氟的最高价氧化物的分子式为F2O7
D.最外层有两个电子的元素在第ⅡA族