1、选择题 下列金属冶炼的反应原理,错误的是(?)。
A.2NaCl(熔融)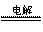 2Na+Cl2↑
2Na+Cl2↑
B.Al2O3+3H2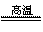 2Al+3H2O
2Al+3H2O
C.Fe3O4+4CO 3Fe+4CO2↑
3Fe+4CO2↑
D.2HgO 2Hg+O2↑
2Hg+O2↑
参考答案:B
本题解析:金属的冶炼一般是根据金属活泼性选择,金属性越强的,采用电解法,越不活泼的金属采用热分解法,处于中间的金属一般采用还原剂还原。铝是活泼的金属,应该通过电解法,工业上用电解熔融的氧化铝来冶炼金属铝,所以答案选B。
本题难度:简单
2、填空题 [选修—化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有??、?。
(2)天然水在净化处理过程中加入的混凝剂可以是?其纯净水作用的原理是?
(3)水的纯净和软化的区别是?
(4)硬度为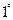 的水是指每升水含10
的水是指每升水含10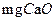 或与之相当的物质(如7.1
或与之相当的物质(如7.1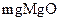 )。若某天然水中
)。若某天然水中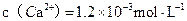 ,
,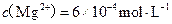 ,则此水的硬度为?;
,则此水的硬度为?;
(5)若(4)中的天然水还含有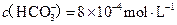 ,现要软化10
,现要软化10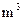 这种天然水,则需先加入
这种天然水,则需先加入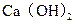 ?
?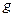 ,后加入
,后加入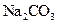 ?
?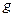 。
。
参考答案:(1)O2? CO2(或氮气)
(2)明矾、硫酸铝、硫酸铁、硫酸亚铁
铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的
(3)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子
(4)10°
(5)740? 1484
本题解析:本题主要考查天然水的净化和软化等知识,要求能根据题中信息计算天然水的硬度,以及通过计算确定软化时化学试剂的加入量。天然水的净化是利用含Al3+、Fe3+和Fe2+等盐的混凝剂水解生成的Al(OH)3或Fe(OH)3胶体吸附水中悬浮物,最终使其聚沉,达到净水的目的。水的软化是指利用化学方法除去水中Ca2+和Mg2+的过程。(4)水的硬度是由Ca2+和Mg2+共同产生的,即硬度为1.2×10-3×56×103/10+6×10-4×40×103/7.1=10°。(5)根据题中数据可以算出10m3这种天然水中含Ca2+为1.2×10-3×10×103=12mol,同理可求出含有Mg2+和HCO3-分别为6mol和8mol。软化硬水时,加入Ca(OH)2发生的反应为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O,Mg2++2OH-=Mg(OH)2↓。两步反应共消耗10mol Ca(OH)2,其质量为740g。此时被沉淀的Ca2+为4mol,水中剩余Ca2+为原天然水中剩余的8mol和加入Ca(OH)2中的6mol,故还需加入14molNa2CO3使其沉淀完全,其质量为1484 g。
本题难度:一般
3、选择题 2011年11月3日“神舟八号”与“天宫一号”首次交会对接,为中国航天第三步建设空间站做准备.下列说法错误的是
A.“天宫一号”使用的太阳能电池板主要成分是硅
B.信息技术的硬件核心是芯片,芯片材料的主要成分是二氧化硅
C.“长征二号F”运载火箭外壳抗高温陶瓷是无机非金属材料?
D.光导纤维是信息高速公路的骨架,其主要成分是石英
参考答案:B
本题解析:分析:A.太阳能电池板含有能导电的硅材料;
B.芯片材料的主要成分是硅;
C.高温陶瓷属于无机非金属材料;
D.光导纤维的主要成分为二氧化硅.
解答:A.太阳能电池板主要成分是硅,能导电,故A正确;
B.芯片材料的主要成分是硅,而不是二氧化硅,故B错误;
C.高温陶瓷属于无机非金属材料,具有耐腐蚀、耐高温的 特点,故C正确;
D.光导纤维的主要成分为二氧化硅,故D正确.
故选B.
点评:本题考查硅和二氧化硅的性质和应用,题目难度不大,注意相关基础知识的积累.
本题难度:一般
4、选择题 我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等.月球的矿产资源极为丰富,仅月面表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[(Mg,Fe)2SiO4](逗号表示两种元素各占一部分)等,下列说法或分析不正确的是( )
A.辉石、斜长石及橄榄石均属于硅酸盐矿
B.斜长石的氧化物形式可表示为:K2O?Al2O3?6SiO2
C.橄榄石中铁为+2价
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
