1、选择题 一定物质的量SO2与NaOH溶液反应,所得产物中含Na2SO3和NaHSO3,则参加反应的SO2与NaOH的物质的量之比为可能为
[? ]
A.1:1 ?
B.1:2 ?
C.3:5 ?
D.2:1
参考答案:C
本题解析:
本题难度:一般
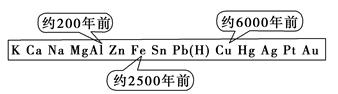
2、选择题 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限。之所以有先后,主要取决于
A.金属的化合价高低
B.金属的活动性大小
C.金属的导电性强弱
D.金属在地壳中的含量多少
参考答案:B
本题解析:Al、Fe、Cu中,Cu的化学性质最不活泼,自然界中存在单质Cu,冶炼比较容易,所以最早被人类发现;Al的化学性质最活泼,所以冶炼程度较难,最晚被人类利用,所以之所以有先后,主要取决于金属的活动性大小,答案选B。
本题难度:简单
3、计算题 在900℃的空气中合成出一种含镧、钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:
⑴ 准确移取25.00 mL 0.05301 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5 mL 6 mol·L-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。
⑵ 准确称取0.4460 g复合氧化物样品,放入锥形瓶中,加25.00 mL上述草酸钠溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。
参考答案:⑴2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
KMnO4溶液浓度: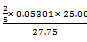 ?=" 0.01910" (mol·L-1)
?=" 0.01910" (mol·L-1)
⑵根据:化合物中金属离子摩尔比为 La : Ca : Mn =" 2" : 2 : 1,镧和钙的氧化态分别为+3和+2,锰的氧化态为 +2 ~ +4,初步判断
复合氧化物的化学式为La2Ca2MnO6+x, 其中x = 0~1。
滴定情况:
加入C2O42-总量:25.00 mL ×0.05301 mol·L-1=" 1.3253" mmol
样品溶解后,滴定消耗高锰酸钾:10.02 mL ×0.01910 mol·L-1 =" 0.1914" mmol
样品溶解后剩余C2O42-量:? 0.1914 mmol × =" 0.4785" mmol
=" 0.4785" mmol
样品溶解过程所消耗的C2O42-量: 1.3253 mmol -0.4785 mmol =" 0.8468" mmol
在溶样过程中,C2O42-变为CO2给出电子:
2 × 0.8468 mmol =" 1.694" mmol
有两种求解x的方法:
(1)方程法:
复合氧化物(La2Ca2MnO6+x)样品的物质的量为:
0.4460 g / [(508.9 + 16.0 x) g·mol-1]
La2Ca2MnO6+x中,锰的价态为: [2 ×(6+x) -2 ×3 -2×2] = (2+2x)
溶样过程中锰的价态变化为: (2+2 x- 2) =" 2" x??
锰得电子数与C2O42-给电子数相等:
2 x× 0.4460 g / [(508.9 + 16.0 x) g·mol-1] =" 2" ×0.8468 ? 10-3 mol
x =" 1.012" ≈1?
(2)尝试法
因为溶样过程消耗了相当量的C2O42-,可见锰的价态肯定不会是+2价。若设锰的价态为+3价,相应氧化物的化学式为La2Ca2MnO6.5, 此化学式式量为516.9 g·mol-1, 称取样品的物质的量为:
0.4460 g / (516.9 g·mol-1) =" 8.628" ×10-4 mol
在溶样过程中锰的价态变化为
1.689× 10-3 mol / (8. 628×10-4 mol) =" 1.96"
锰在复合氧化物中的价态为:? 2 + 1.96 =" 3.96?"
3.96与3差别很大,+3价假设不成立;?
而结果提示Mn更接近于+4价。?
若设Mn为+4价, 相应氧化物的化学式为La2Ca2MnO7, 此化学式式量为524.9 g·mol-1。
锰在复合氧化物中的价态为:2 + 2 × 0.8468 ×10-3 / (0.4460 / 524.9) =" 3.99" ≈ 4?
假设与结果吻合,可见在复合氧化物中,Mn为+4价。?
该复合氧化物的化学式为La2Ca2MnO7
溶样过程的反应方程式为:
La2Ca2MnO7 + C2O42- + 14H+ = 2La3+ + 2Ca2+ + Mn2+ + 2CO2 + 7H2O
本题解析:⑴此过程为标准溶液的标定,根据关系式5C2O42-~2MnO4-,用C2O42-标准溶液标定出MnO4-的浓度。
⑵该分析过程属于容量分析的返滴定类型,用KMnO4滴定过量的C2O42-。根据电子得失守恒关系,可列出下式
Mn元素得失电子数+5×n(MnO4-)=2×n(C2O42-)
求得Mn元素得失电子的物质的量为1.694 mmol
设复合氧化物的通式(La2Ca2MnO6+x),求得氧化物中Mn的物质的量,进而求得滴定过程中锰元素氧化数的变化,最终确定氧化物中锰的氧化数。
本题难度:一般
4、实验题 用图所示的装置制取氢气,在塑料隔板上放粗锌粒.漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹。则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生,这是一种仅适用于室温下随制随停的气体发生装置。
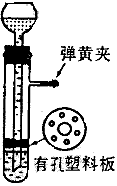
回答下列问题:
(1)为什么关闭弹簧夹时试管中液面会下降?
______________________________________________。
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
______________________________________________。
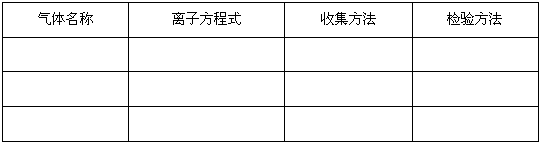
(3)从下面三个反应中选择可以用这种随制随停的制气装置制取的气体,填写下表中的空白。
①大理石与盐酸反应制取CO2
②硫化亚铁与盐酸反应制取硫化氢
③用二氧化锰催化分解过氧化氢制氧气
?(4)食盐跟浓硫酸反应制取氯化氢不能用这种装置,试说明理由。
_________________________________________________
参考答案:(1)关闭弹簧夹,反应产生的气体使试管内液面上的压力增加,所以液面下降。
(2)塞紧橡皮塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气
(3)
气体名称
离子方程式
收集方法
检验方法
二氧化碳
CaCO3+2H+==Ca2++CO2↑+H2O向上排空气法通入澄清石灰水
硫化氢
FeS+2H+==Fe2++H2S↑ 向上排空气法有臭鸡蛋味(或通入硫酸铜溶液)(4)因为此反应需要加热且食盐是粉末状
本题解析:
本题难度:困难
5、填空题 近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量杂质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为 ___C+__K2Cr2O7+__H2SO4(稀)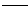 __CO2+___K2SO4+__ Cr2(SO4)3+____
__CO2+___K2SO4+__ Cr2(SO4)3+____
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是______________,氧化产物是______________。
(3)H2SO4在上述反应中表现出来的性质是_______(填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
参考答案:(1)3C+2K2Cr2O7+8H2SO4(稀)=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(2)K2Cr2O7;CO2
(3)A
本题解析:
本题难度:一般