1、选择题 已知下面三个数据:7.2×10-4、4.6×10-4、4.9 ×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF
由此可判断下列叙述不正确的是
[? ]
A.K(HF)=7.2 ×10-4
B.K(HNO2)=4.9 ×10-10
C.根据其中两个反应即可得出结论
D.K(HCN)<K(HNO2)<K(HF)
参考答案:B
本题解析:
本题难度:一般
2、填空题 Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2++2OH-?
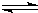
?M(OH)2?
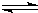
?2H++MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25C°?时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)______,C(H+)______,水的电离度______,Kw______
(2)25C°?时,向A的稀溶液中加入少量的烧碱固体.则水的电离度______,溶液的pH______
Ⅱ、.室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为______?10?(填大于、等于或小于)
参考答案:(1)①因为A的溶液呈中性,所以25C°时,在蒸馏水中加入A物质后,对水的电离无影响,所以由水电离出的C(OH-)、C(H+)、水的电离度、Kw均不变,故答案为:不变;不变;不变;不变;
(2)25C°时,向A的中性稀溶液中加入少量的烧碱固体,相当于碱性溶液,碱对水的电离起抑制作用,水的电离程度减小,故答案为:减小;增大;
(3)氨水的浓度越小,则电离度越大,遵循越稀越电离的原理,0.1mol/L的氨水比较容易电离,氢氧根浓度大与1mol/L氨水中氢氧根离子浓度的110,所以这个比值应该小于10,故答案为:小于.
本题解析:
本题难度:一般
3、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是? ( )
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
参考答案:D
本题解析:醋酸溶液存在如下电离平衡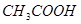 ?
? ;加水稀释,平衡向右移动,所以
;加水稀释,平衡向右移动,所以
A错,加水稀释,溶液中的c(CH3COO-)呈减小趋势;B错,加水稀释,溶液中的c(H+)呈减小趋势;C错,电离平衡常数只受温度影响,与其他因素无关;D正确,溶液中的c(H+)呈减小趋势则溶液中的c(OH-)呈增大趋势;
本题难度:一般
4、选择题 在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  ?CH3COO-+H+对于该平衡,下列叙述正确的是
?CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
参考答案:B
本题解析:A、加水促进弱电解质的电离,则电离平衡正向移动,故A错误;B、加入少量NaOH固体,与CH3COOH电离生成的H+结合,使电离平衡正向移动,故B正确;C、加入少量0.1mol?L-1HCl溶液,c(H+)增大,则电离平衡逆向移动,故C错误;D、加入少量CH3COONa固体,由电离平衡可知,c(CH3COO-)增大,则电离平衡逆向移动,故D错误。
本题难度:一般
5、选择题 向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为(?)
A.减小、减小、增大
B.减小、增大、增大
C.增大、减小、减小
D.减小、减小、减小
参考答案:
A
本题解析:
本题考查电离平衡。 NaHCO3溶液中存在平衡:HCO3- H++CO32-,加入冰醋酸,H+浓度增大,平衡逆向移动,CO32-的浓度减小,加入Ca(OH)2,H+浓度减小,平衡右移,但是Ca2+与CO32-生成CaCO3沉淀,CO32-浓度减小,加入NaAlO2,发生反应H++AlO2-+H2O=Al(OH)3↓,H+减小,平衡右移,CO32-浓度增大,A项正确。
H++CO32-,加入冰醋酸,H+浓度增大,平衡逆向移动,CO32-的浓度减小,加入Ca(OH)2,H+浓度减小,平衡右移,但是Ca2+与CO32-生成CaCO3沉淀,CO32-浓度减小,加入NaAlO2,发生反应H++AlO2-+H2O=Al(OH)3↓,H+减小,平衡右移,CO32-浓度增大,A项正确。
本题难度:一般