1、选择题
L-1的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量
B.电离度
C.H+的物质的量
D.CH3COOH的物质的量
参考答案:BC
本题解析:两溶液中CH3COOH的物质的量都是:0.001 mol,中和时所需NaOH的量也应相等;浓度越小,电离度越大,其电离出的H+的物质的量也就越多。
本题难度:简单
2、选择题 在醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,要使电离平衡向右移动且c(H+)增大,可采取的措施是( )
A.加NaOH(s)
B.加盐酸
C.升高温度
D.加蒸馏水
参考答案:A、加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,能促进醋酸的电离,但氢离子浓度减小,故A错误;
B、加入盐酸能增大氢离子浓度但抑制醋酸的电离,故B错误;
C、醋酸的电离是吸热反应,升高温度能促进醋酸的电离,且氢离子浓度大,故C正确;
D、加蒸馏水能促进醋酸的电离,但氢离子浓度减小,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 下列三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2?NaCN+HF=HCN+NaF?NaNO2+HF=HNO2+NaF
由此可判断下列叙述中正确的是 ?
A.HF的电离平衡常数是①
B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是②
D.HNO2的电离平衡常数是③
参考答案:A
本题解析:根据较强的酸制备较弱的酸可知,酸性强弱顺序是HF>HNO2>HCN,所以根据电离常数可知,三种酸的电离常数分别是②、①、③,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题,属于基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是利用好较强酸制备较弱酸的原理,然后结合题意灵活运用即可。
本题难度:一般
4、填空题 (16分)
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
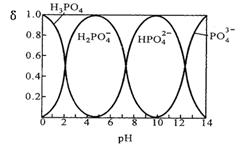
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na3PO4溶液中,c(Na+)/c(PO43—) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
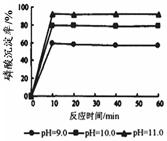
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 。
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:

①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
参考答案:I.①酸 (1分);H2PO4-在溶液中的电离程度大于水解程度。(1分)
② > (1分), KOH抑制了PO43-的水解(1分);③0.056mmol·/(L·min)(3分)
II. ①4.00×10-4
②如图 (2分)
(2分) ③
③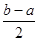 mol/L (2分)
mol/L (2分)
本题解析:I. ①根据图示可知H2PO4-存在的溶液的pH是2—7,所以NaH2PO4溶液呈酸性;这说明H2PO4-在溶液中的电离程度大于水解程度。②在Na3PO4溶液中,由于PO43—水解消耗,所以c(Na+)/c(PO43—)>3;向该溶液中滴入几滴浓KOH溶液,由于c(OH-)增大,水解平衡逆向移动,c(PO43-)增大,所以c(Na+)/c(PO43-)的值减小;③在溶液的pH=10.0时,磷酸的沉淀率是80%,由于开始时磷酸的浓度是0.70mol/L,所以磷酸的沉淀速率是V=(0.70mol/L×80%)÷10min=0.056mmol·/(L·min);II. ①求该温度时,氨水的电离平衡常数K K=c(NH4+)?c(OH-)/c(NH3·H2O)="(0.02mol/L×0.02mol/L" ) ÷1mol/L=4.00×10-4 mol/L;②②在t1时刻时再加入H2O配成2L溶液,由于浓度减小,所以离子的浓度减小,假如电离平衡不发生移动,则c(OH-)=0.01mol/L,而加水稀释,平衡向电离的方向移动,所以c(OH-)有逐渐增大,到t2时刻时重新达到平衡。由于温度不变,所以电离平衡常数不变,K=c(NH4+)?c(OH-)/c(NH3·H2O)= 4.00×10-4 mol/L,假设平衡时c(OH-)=x,则x2/0.5mol/L= 4.00×10-4 mol/L,所以x=1.4×10-2mol/L=0.014mol/L.在t2时刻时重新达到平衡,在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线为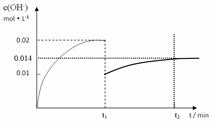 。③若二者等浓度等体积混合,则溶液为NH4Cl溶液,该盐是强酸弱碱盐水解使溶液显碱性,所以若溶液为中性,则应该碱过量,过量的碱电离使溶液的碱性与盐水解是溶液表现的酸性抵消,所以将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=
。③若二者等浓度等体积混合,则溶液为NH4Cl溶液,该盐是强酸弱碱盐水解使溶液显碱性,所以若溶液为中性,则应该碱过量,过量的碱电离使溶液的碱性与盐水解是溶液表现的酸性抵消,所以将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=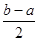 mol/L。
mol/L。
考点:考查溶液的酸碱性与离子的存在的关系、化学反应速率、电离平衡常数的计算、稀释对弱电解质电离平衡的影响的图像法表示及酸碱混合溶液中过量的物质的量浓度的计算的知识。
本题难度:困难
5、选择题 在CH3COOH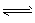 CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
[? ]
A.加入NaOH固体
B.加浓盐酸
C.加水
D.加热
参考答案:D
本题解析:
本题难度:一般