| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《电解质和非电解质》高频试题巩固(2019年最新版)(二)
参考答案:B 本题解析:A.钠的质地柔软,能用小刀切割,正确;B.金属铝可以和强酸以及强碱反应,所以不可用铝制餐具长时间存放酸性或碱性食物,错误;C.钠性质很活泼,能和水、氧气反应,所以为防止钠燃烧,必须隔绝空气和水,一般用细沙覆盖灭火,正确;D. KAl(SO4)2溶于水的电离方程式为:KAl(SO4)2==K++Al3++2SO42—,正确。 本题难度:一般 2、填空题 现有下列物质:①Na2CO3 ②铜 ③氯化氢 ④CO2 ⑤NaHSO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩KI
(2)上述某两种物质在溶液中可发生离子反应:H++OH-= H2O,写出其中一个该离子反应对应的化学方程式 。 (3)物质⑩的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为: 。 参考答案: 本题解析:(2)符合离子反应H++OH-= H2O应为强酸和强碱反应,且不能生成沉淀、气体等产物,所以应用氯化氢、稀硝酸于Ba(OH)2反应;(3)碘离子具有较强的还原性,根据题意其被氧化为碘单质,溶液为中性环境,方程式为O2 + 4I- + 2 H2O = 2I2 + 4OH-。 本题难度:一般 3、选择题 下列说法错误的一组 |
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (10分)按要求填空:
(1)2.7 g H2O所含氢原子数与 L(标准状况下)NH3所含氢原子数相等。
(2)以下物质:① NH3 ② CaCO3 ③ 蔗糖 ④ 饱和食盐水 ⑤ H2SO4 ⑥Cu
属于电解质的有 (填序号)。
(3)用单线桥标出下列反应中电子转移的方向和数目:
MnO2+4HCl(浓)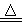 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
① 该反应中的氧化剂是 。
②如反应中转移了0.2 mol电子,则产生的Cl2在标准状况下体积为 L。
参考答案:(1) 2.24 (2) ②、⑤
(3) ① MnO2 ② 2.24
① MnO2 ② 2.24
本题解析:(1)2.7 g H2O的物质的量为:n="m/M=2.7g÷18g/mol=0.15mol," 氢原的物质的量为:0.15mol×2=0.3mol,则NH3的物质的量为0.1mol,V=n×22.4L/mol=0.1mol×22.4L/mol=2.24L (2)电解质主要包括酸、碱、盐和水,①NH3是非电解质 ②CaCO3 属于盐类,是电解质 ③ 蔗糖是非电解质 ④ 饱和食盐水是混合物,既不是电解质也不是非电解质 ⑤H2SO4属于酸,是电解质,⑥Cu属于单质既不是电解质也不是非电解质。(3)单线桥表电子转移方向和数目时箭头是从还原剂指向氧化剂,在线桥注明电子的转移个数,根据化合价的改变:Mn从+4价降低变为+2价,Cl从-1价升高到0价,所以氧化剂是MnO2,还原剂是HCl,转移电子数为2e-,则用单线桥标出下列反应中电子转移的方向和数目为: ,如反应中转移了0.2 mol电子则生成Cl2为0.1mol,,V="n×22.4L/mol=0.1mol×22.4L/mol" =2.24L
,如反应中转移了0.2 mol电子则生成Cl2为0.1mol,,V="n×22.4L/mol=0.1mol×22.4L/mol" =2.24L
考点:电解质的判断,有关物质的量的计算、氧化还原反应的基本知识。
本题难度:一般
5、选择题 今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是
A.1:1:1
B.3:2:1
C.3:2:3
D.1:1:3
参考答案:D
本题解析:根据三种硫酸盐的化学式可知,溶液中硫酸根的浓度分别是0.1mol/L、0.1mol/L、0.1mol/L×3=0.3mol/L,所以这三种溶液中硫酸根离子浓度之比是1:1:3,答案选D。
考点:考查物质的量浓度的有关计算
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《原电池原理.. | |