| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》试题巩固(2019年最新版)(六)
参考答案:C 本题解析:该图所示的电化学装置其实是以甲乙和盐桥形成原电池并以该原电池为电源形成丙电解池。电极I是负极、电极II是正极、电极III是阳极、电极IV是阴极。A、甲是原电池,电极I为锌,作负极,电子由负极I通过外电路流向阴极IV, A错误;B、装置工作过程中作为阳极的III电极Cl—失去电子产生氯气,电极周围不出现红色, B错误;C、电极II为原电池的正极Cu2+离子在这里得电子被还原,发生还原反应,C正确;D、原电池中阴离子向负极移动,故盐桥中Cl—向甲池移动,D错误。答案选C。 本题难度:一般 4、填空题 甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。 |
参考答案:化学反应式或方程式未配平的均扣1分
(1)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ/mol (2分,方程式1分,反应热2分,状态错误扣1分,计量数错误不得分。)
(2) ① BD (2分,少选扣1分,有错选不得分)
② 0.4mol/(L·min) 或6.67×10-3 mol·L-1·s-1(2分,无单位不得分)
③ 0.99 (2分,数值在1.0~0.98之间均得分,写成“ ”或“
”或“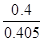 ” 得1分,单位不做要求。)
” 得1分,单位不做要求。)
④
(3)① CH3OH-6e-+H2O=CO2↑+6 H+ (2分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
② 铝制品(1分,写“Al”或“铝”均可,其他书写不得分)
2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O(3分,或“Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+3CO2↑,2Al(OH)3=Al2O3+3H2O”各1分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
本题解析:(1)先写出三种物质的燃烧热的热化学方程式。
① CO(g) △H1=-283.0kJ/mol
△H1=-283.0kJ/mol
② H2(g)+ 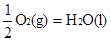 △H2=-285.8 kJ/mol
△H2=-285.8 kJ/mol
③ CH3OH(1)+ 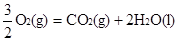 △H3=-726.5kJ/mol
△H3=-726.5kJ/mol
再写出目标方程式:CO(g)+2H2(g)=CH3OH(l) △H4
根据盖斯定律, ①+②×2-③即得到目标方程式。 △H4= △H1+△H2×2-△H3=-128.1kJ/mol
根据图像: CO(g)+2H2(g)=CH3OH(l)
起始:(mol/L) 0.9 x 0
0-2min(mol/L) —0.4 —0.8 0.4
2-4min(mol/L)(平衡) 0.5 0.9 0.4
4-6min(mol/L) —0.2 —0.4 0.2
6-8min(mol/L)(平衡) 0.3 0.5 0.6
8-10min(mol/L) —0.1 —0.2 0.1
10-12min(mol/L)(平衡)0.2 0.3 y
①A项,起始时浓度x=C(H2)为1.7mol/L,容器体积未知,所以物质的量也未知,A项错误。
B项,该容器是一个恒容的容器,反应是一个非等体积反应,因此当气体的总物质的量不再改变,即压强不再改变,反应即达到平衡状 态,正确。
C项,4min时,平衡向右移,并且各物质的浓度是逐渐变化,所以应该是降温的条件下,C项错误。
D项,7min时,反应再次达到平衡,此时v(CO)=v(CH3OH),D项正确。
②0~2min内平均反应速率v(H2)=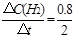 ="0.4" mol·L-1·min-1
="0.4" mol·L-1·min-1
③在3min时该反应的平衡常数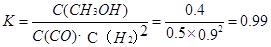
④在第8min时,CO的浓度减少0.1mol·L-1,H2的浓度减少0.2mol·L-1,可知平衡在向右移动,CO和H2的浓度都是逐渐变小,而此时的条件和上次平衡移动的条件不相同,所以只能是减少甲醇的浓度,才能使平衡向右移动,即在平衡移动的瞬间,甲醇的浓度是很少的,应该要低于0.05mol·L-1,然后再增加0.1mol·L-1,在第10min平衡,并且浓度y不超过0.15mol·L-1。
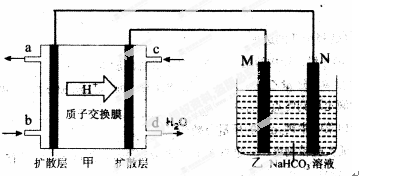
(3)该装置中甲是一个燃料电池装置,给右边的装置乙提供电能,乙装置是一个电解池装置。
①甲中质子移向右边,从而推知甲装置左是负极,右是正极,则乙装置中M是阳极,N是阴极。甲中电池的负极反应式为:CH3OH-6e-+H2O=CO2↑+6 H+ 要注意电解质溶液质子在进行传递。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。则阳极M材料是铝制品,阴极N材料是石墨。在铝表面钝化,即把铝变成Al2O3,同时考虑溶液中溶质为NaHCO3,则电极反应为:2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O
考点: 考查热化学方程式的书写、化学平衡原理及其图像问题、电化学综合。
本题难度:困难
5、选择题 在理论上不能用于设计原电池的化学反应是
A.H2SO4 (aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2
2CO2(g)+3H2 O(l) ;△H<0
O(l) ;△H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ;△H<0
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g )+4H2O(l) ;△H<0
)+4H2O(l) ;△H<0
参考答案:A
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《电解质和非.. | |