1、选择题 按下图装置进行电解实验:A极是铜锌合金,B极为纯铜。电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7. 68g,溶液质量增加 0. 03g,则合金中Cu、Zn原子个数比为
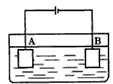
[? ]
A.6:1
B.4:1
C.3:1
D.任意比
参考答案:C
本题解析:
本题难度:一般
2、选择题 在25℃时,用石墨电极电解2.0 L2.5 mol/L CuSO4溶液(假设溶液的体积在电解前后不发生变化)。5min后,在一个石墨电极上有6.4 gCu生成。下列说法中正确的是
[? ]
A. 有Cu生成的一极是阴极,发生氧化反应
B. 反应中转移电子的物质的量为0.4 mol
C. 在另一极得到O2的体积(标准状况)是1.12 L
D. 此时溶液的pH为2
参考答案:C
本题解析:
本题难度:一般
3、选择题 10mL?0.05mol/L含有R2O72-离子的浓溶液恰好能将10mL?0.05mol/L的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
A.+1价
B.+2价
C.+3价
D.+6价
参考答案:C
本题解析:
本题难度:简单
4、选择题 已知:2Fe2++Br2=2Fe3++2Br-若向100 mL FeBr2溶液中缓慢通入2.24 L标况下的氯气,充分反应后,有1/5的Br-被氧化成Br2,则原FeBr2溶液的物质的量浓度为
A.1.4 mol/L
B.2.5 mol/L
C.5.0 mol/L
D.无法计算
参考答案:A
本题解析:
本题难度:一般
5、简答题 在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中,若有3.2g的Cu参与反应,则被还原的H2SO4的物质的量是______mol.
参考答案:n(Cu)=3.2g64g/mol=0.05mol,
Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O? 被还原H2SO4
1mol? 1mol
0.05mol?n
n=0.05mol,
故答案为:0.05.
本题解析:
本题难度:一般