1、简答题 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:
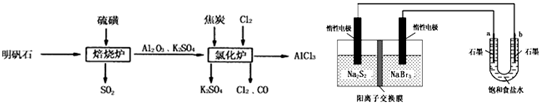
(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液?②氯化亚铁溶液?③硫氰化钾溶液?④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a?mol变为b?mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失).
参考答案:(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小,
故答案为:酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小;
(2)焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动,
故答案为:焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动;
(3)取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应,
故答案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应;
(4)①惰性电极电解饱和氯化钠溶液,生成氢气、氯气、氢氧化钠,电解总反应式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液钠离子向正极移动,即向右槽移动;
由反应2Na2S2+NaBr3?放电?.?Na2S4+3NaBr可知,左侧S22-放电生成S42-,电极反应式为:2S22--2e-=S42-,
故答案为:右槽;2S22--2e-=S42-;
③该原电池工作一段时间后,测得左槽中Na+物质的量由a?mol变为b?mol,则转移电子的物质的量为(a-b)mol,电解池中b电极连接电源的正极,为阳极,得到的气体为氯气,根据电子转移守恒可知氯气的物质的量为你(a-b)mol2,故生成氯气的体积=(a-b)mol2×22.4L/mol=11.2(a-b)L,
故答案为:11.2(a-b).
本题解析:
本题难度:一般
2、推断题 甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,已知:
(Ⅰ)A和B都极易溶于水,用两根玻璃棒分别蘸取A和B 的浓溶液后,相互靠近会看到白烟;
(Ⅱ)各物质之间存在如下图所示的转化关系:

请回答下列问题:
(1)C溶液显____(填“酸”“碱”或“中”)性,若A溶液的物质的量浓度是B溶液的物质的量浓度的2倍,则等体积混合后溶液中各离子浓度由大到小的顺序为____________(用离子符号表示)。
(2)一定条件下,乙气体与甲气体充分反应生成6.8 g A气体,可放出18.44 kJ热量,则该反应的热化学方程式为____________________
(3)在一定温度下,向容积不变(容积为10 L)的密闭容器中加入2 mol乙气体、8 mol甲气体及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为:
________,反应达平衡状态时甲气体的转化率为________,若想提高A的产率,根据化学平衡移动原理,请提出合理的建议:____________(任意写一条)。在上述平衡中,若再加入2 molA气体、2 mol乙气体,则此时化学平衡将________(填“向正方向”“向逆方向” 或“不”)移动。
(4)白色沉淀M可溶于A的水溶液,这与AgOH溶于A的水溶液类似,写出该反应的离子方程式_________。
参考答案:(1)酸;c(NH4+) >c(Cl-)>c(OH-)>c(H+)
(2)N2(g)+3H2(g)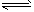 2NH3(g); △H= -92.2 kJ/mol
2NH3(g); △H= -92.2 kJ/mol
(3)0.01 moL/(L·min);37.5%;增大氢气浓度或增大氮气浓度(或增大反应物浓度)或及时移出氨气或降低温度或增大压强;向逆方向
(4)AgCl+2NH3·H2O==Ag(NH3)2++Cl-+2H2O
本题解析:
本题难度:一般
3、选择题 对于平衡CO2(g) CO2(aq);ΔH=-19.75?kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq);ΔH=-19.75?kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
[? ]
A.升温增压
B.降温减压
C.升温减压? ?
D.降温增压
参考答案:D
本题解析:
本题难度:一般
4、填空题 1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应并达平衡:
Na2SO4(s)+4H2(g)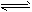 Na2S(s)+4H2O(g),△H<0,
Na2S(s)+4H2O(g),△H<0,
在恒温恒容时回答以下问题
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入Na2SO4________________。②加入焦炭________________。
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,Na2SO4的转化率是
_______________。
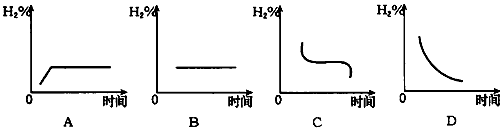
(3)若将容器温度升高20℃,H2在混合气体中含量变化用图中 _______图表示最合适。
参考答案:(1)①无影响;②有影响,正向移动
(2)50%
(3)D
本题解析:
本题难度:一般
5、选择题 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+ 3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+ 3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
[? ]
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
参考答案:C
本题解析:
本题难度:一般