1、选择题 水是人类生活不可缺少的物质。日常生活中不少人喜欢喝纯净水,市售的纯净水有些就是蒸馏水。有关这类蒸馏水的说法正确的是
A.它可以通过冷却自来水受热产生的水蒸气而获得
B.它清洁、纯净,长期饮用对健康有益无害
C.它含有人体所需的矿物质和多种维生素
D.它是纯天然饮品,不含任何化学物质
参考答案:A
本题解析:
本题属于事实记忆型试题,要求学生对课本知识进行熟练掌握,较易。
A正确,蒸馏的步骤是:自来水→蒸发→蒸汽→冷凝→蒸馏水。
B错误,蒸馏水中缺乏人体所需矿物质,长期饮用对健康无益,甚至有害。
C错误,蒸馏水不含矿物质和维生素。
D错误,自然界不存在蒸馏水,蒸馏水都是人工制取的非天然饮品。水也是化学物质,说某饮料食品不含化学物质是不科学的。
本题难度:简单
2、选择题 常温下,能与SiO2发生反应的物质是(?)
A.烧碱
B.氢氟酸
C.水
D.氧化钙
参考答案:AB
本题解析:常温下能与二氧化硅反应的只有烧碱与氢氟酸,氧化钙可在高温下与二氧化硅反应,水在高温下也不与二氧化硅反应。
本题难度:简单
3、选择题 人类将在二十一世纪大量使用氢气作燃料,其中最理想的获取氢气的途径是
A.以焦炭和水制取水煤气后分离出氢气
B.用铁、锌等活泼金属与稀硫酸制取氢气
C.由火力发电厂提供电力电解水产生氢气
D.利用高效催化剂和太阳能使海水分解产生氢气
参考答案:D
本题解析:略
本题难度:简单
4、实验题 金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:

已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
参考答案:(1) 2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4) 3+4H2SiO3↓(2分)。
(2) Al(OH)3和CaCO3 (2分)? (3)酒精灯(1分)?玻璃棒(1分)。
(4)碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li2CO3),以便产生碳酸锂沉淀。(3分)
(5)SiO2+4HF=SiF4↑+2H2O(2分)。(6) 1148(2分)。
本题解析:β—辉锂矿溶于硫酸生成硫酸锂、硫酸铝、和硅酸沉淀,过滤除去硅酸,滤液中加入Ca(OH)2和Na2CO3后生成CaCO3和Al(OH)3就是沉淀B,过滤,得到硫酸锂溶液,蒸发浓缩后,加入Na2CO3得到Li2CO3沉淀,加盐酸得到LiCl,电解得锂。(6)吸收氢气10摩尔,生成LiH20摩尔,质量是160克,体积是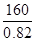 毫升,氢气体积22400毫升,体积比为1:1148
毫升,氢气体积22400毫升,体积比为1:1148
本题难度:困难
5、选择题 结合我们学过的知识,下列关于钙、铁、铜的冶炼方法正确是
A.电解法热分解法热还原法
B.热还原法热分解法电解法
C.电解法热还原法热还原法
D.电解法电解法热分解法
参考答案:C
本题解析:考查金属的冶炼;钙为活泼金属一般用电解法;铁、铜一般用CO或C的热还原的方法;
本题难度:简单