1、选择题 19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了 (? )
A.大量铝土矿
B.电解氧化铝制取铝的方法
C.用金属钠还原氧化铝的方法
D.无水氯化铝与钾制取铝的方法
参考答案:B
本题解析:金属铝比较活泼,不易还原,从矿石中很难到。金属铝的冶炼方法先进主要为点解氧化铝的方法。
本题难度:简单
2、选择题 婴儿用的一次性尿布中有一层能吸水、保水的物质,也有人建议可用此物质对沙漠进行治理。下列高分子中有可能被采用的有(?)
A.
B.
C.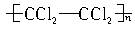
D.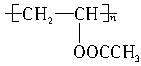
参考答案:B
本题解析:羟基为亲水基,与水分子易形成氢键,故含有羟基的高分子有可能被采用。
本题难度:一般
3、选择题 祖母绿是含铬(以Cr2O3形式存在)等微量元素的矿物,其主要成分为Be3Al2Si6O18
(Be3Al2Si6O18为无色透明),下列说法不正确的是
A.祖母绿是一种硅酸盐矿物
B.其主要成分可用氧化物形式表示:3BeO·Al2O3·6SiO2
C.绿色是Cr2O3表现出来的
D.祖母绿是多种氧化物组成的混合物
参考答案:D
本题解析:
答案:D
D.不正确,祖母绿是硅酸盐。
本题难度:简单
4、填空题 (9分)工业上从海水中提取溴的方法如下:
①将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化;
②向酸化的海水中通入足量氯气,使溴离子转化为溴单质;
③向上述溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫水溶液的吸收塔内转化成氢溴酸;④向吸收塔内通入适量的氯气;
⑤用四氯化碳萃取吸收塔中的溴单质。
请完成下列问题:
(1)在实验室中蒸馏海水制淡水时,常用的仪器除了酒精灯、锥形瓶、牛角管、冷凝管、石棉网及必要的夹持仪器,还需要的玻璃仪器有?;蒸馏时碎瓷片的作用是____________________。
(2)步骤②中反应的离子方程式为?
(3)步骤③的目的是使溴单质富集,试写出溴单质与二氧化硫水溶液反应的化学方程式?。反应中_________(写化学式)是氧化剂。1mol氧化剂在反应中得到?mol电子。
(4)下列能代替四氯化碳来萃取溴的试剂是?(填序号)
A.盐酸
B.酒精
C.乙酸
D.苯
参考答案:(9分)(1)蒸馏烧瓶(2分);防止暴沸?(2分)
(2)C12+2Br-= Br2+2C1-?(2分)
(3)SO2 + Br2 + 2H2O = 2HBr + H2SO4?(2分);? Br2(2分)? 2?(2分)
(4)D?(2分)
本题解析:(1)考查蒸馏实验。根据蒸馏实验原理可知,还缺少的玻璃仪器是蒸馏烧瓶。因为在加热时,溶液会剧烈的跳动,所以碎瓷片的作用是防止暴沸。
(2)氯气的氧化性其余单质溴的,能把溴离子氧化生成单质溴,方程式为C12+2Br-= Br2+2C1-。
(3)单质溴也具有氧化性,能把SO2氧化生成硫酸,方程式为SO2 + Br2 + 2H2O = 2HBr + H2SO4。溴元素的化合价由0价降低到-1价,所以1mol单质溴得到2mol电子。
(4)ABC均是和水互溶的,不能用作萃取剂,苯不溶于水,且单质溴易溶在苯中,所以答案选D。
本题难度:一般
5、填空题 (8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:

在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度= ?× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
?× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式? ?。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为?。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为?。
参考答案:(8分)(1)6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O
(2)14.29%;Fe35(OH)15(SO4)45·54H2O
本题解析:略
本题难度:简单