1、简答题 海水的综合利用可以制备金属钠和镁,其流程如下图所示:
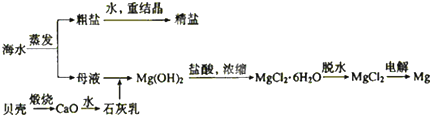
(1)上述流程中生成氢氧化镁沉淀的离子方程式为______.氢氧化镁沉淀和盐酸反应的离子方程式为______.
(2)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:溶解时:______;过滤时:______;蒸发时:______.
参考答案:(1)石灰乳和卤水中的氯化镁反应生成氢氧化镁沉淀和氯化钙,方程式为:MgCl2+Ca(OH)2=Mg(OH)2+CaCl2,离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,氢氧化镁和盐酸反应得到氯化镁和水,化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
故答案为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+;Mg(OH)2+2H+=Mg2++2H2O;
(2)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤中都要用到玻璃棒:溶解时使用玻璃棒搅拌,加速粗盐的溶解;过滤时玻璃棒引流,溶液沿玻棒流下,防止溶液外洒;蒸发时使用玻璃棒搅拌,使溶液受热均匀,防止因局部过热液滴或晶体飞溅,
故答案为:搅拌,加速粗盐的溶解;引流,溶液沿玻棒流下;搅拌,使溶液均匀受热;
本题解析:
本题难度:一般
2、选择题 以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
①粗铜与直流电源负极相连?
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
A.②③
B.②④
C.③④
D.①③
参考答案:A
本题解析:
本题难度:简单
3、实验题 某课外活动小组用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与a连接,则B极的电极反应式为________________。
(2)若开始时开关K与b连接,则B 极的电极反应式为____________________,总反应的离子方程式为
___________________有关上述实验,下列说法正确的是(填序号)__________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2. 24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾 溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_________________。此时通过阴离子交换膜的离子数_____(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、 “C”或“D”)____导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因_______________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为________。
参考答案:(1)Fe-2e-=Fe2+
(2)2H++2e-=H2;2Cl-+2H2O 2OH-+H2↑+Cl2↑;②
2OH-+H2↑+Cl2↑;②
(3)①4OH--4e-=2H2O+O2↑;小于;②D;③H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>
c(H+);④O2+2H2O+4e-=4OH-
本题解析:
本题难度:一般
4、选择题 (改编)下列说法正确的是( )
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.电解MgCl2饱和溶液,可制得金属镁
C.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏高
参考答案:AD
本题解析:
本题难度:一般
5、选择题 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是?
[? ]
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
参考答案:C
本题解析:
本题难度:一般