1、选择题 等质量的下列气体中,所含原子数最少的是
A.CH4
B.CO2
C.H2S
D.N2
参考答案:B
本题解析:所含原子数最少即原子的物质的量最少,在质量相同的情况下,CH4所含原子的物质的量为: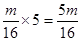 ;CO2所含原子的物质的量为
;CO2所含原子的物质的量为 ;.H2S所含原子的物质的量为
;.H2S所含原子的物质的量为 ;.N2所含原子的物质的量为
;.N2所含原子的物质的量为 ,所以等质量的下列气体中,所含原子数最少的是CO2
,所以等质量的下列气体中,所含原子数最少的是CO2
本题难度:简单
2、选择题 用NaOH固体配制一定物质的量浓度的溶液200 mL,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是
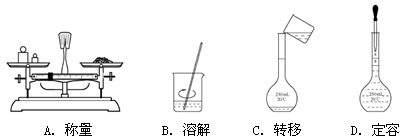
参考答案:B
本题解析:A、天平称量时左物有码,而图中是左码右物了,错误;B、溶解时用玻璃棒不断搅拌,目的是加速溶解,正确;C、配制溶液中转移液体需要玻璃棒引流,图中缺少玻璃棒,错误;D、定容时,胶头滴管不能伸入容量瓶,应是容量瓶口正上方,错误。
考点:考查实验的基本操作。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是?
A.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1 NA个胶粒
B.1molCu与足量的硫固体反应转移的电子数为NA
C.标准状况下,2.24 L三氧化硫所含分子数为0.1NA
D.只有在标准状况下,NA个氧气分子所占的体积才是22.4 L
参考答案:B
本题解析:A选项错误,胶粒是小分子的集合体,所以在氢氧化铝胶体中胶粒数小于0.1NA.
B正确,可变价金属与S反应生成低价金属硫化物,2Cu+S=Cu2S.转移电子数为NA,应该选B.
C选项错误,标况下的三氧化硫是固体.
D选项错误,在非标准状况下,1mol氧气也有可能占22.4L的体积.
本题难度:一般
4、选择题 下列叙述正确的是
A.将5.85 g NaCl晶体溶入100 mL水中,制得0.10 mol/L的NaCl溶液
B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L
C.将w g a%的NaCl溶液蒸发掉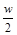 g水,可得到2a%的NaCl溶液(
g水,可得到2a%的NaCl溶液(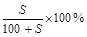 >2a%)
>2a%)
D.将1体积c1mol/L的硫酸用水稀释为5体积,所得稀溶液的浓度为0.2c1mol/L
参考答案::CD
本题解析:A.应将5.85 g NaCl晶体溶入水中配制成100ml,制得0.10 mol/L的NaCl溶液;
B. 25 g无水CuSO4物质的量约为0.16mol溶于水制成100 mL溶液,其浓度大于1 mol/L;
C溶液蒸发一半质量,溶液浓度增大一倍。所以正确。
D可根据溶液稀释公式计算,正确。
点评:掌握有关物质的量浓度相关计算。
本题难度:一般
5、计算题 (6分)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液。计算:(请写出计算过程,保留1位小数)
(1)该混合溶液中NaCl的质量分数。
(2)该混合溶液中NaCl的物质的量浓度。
(3)在1000 g水中需加入________摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。
参考答案:22.(6分)(每空2分) (1) 20.0% (2) 4.0 mol·L-1 (3) 4.3
本题解析:(1)混合液的质量分数=[(m1W1+m2W2)÷(m1+m2)]×100%=[(20.0g×14%+30.0g×24%)/(20.0g+30.0g)]×100%=20%
(2)混合液的体积="m/p=50.0/1.17=5/117L," 溶质的物质的量=(20.0g×14%+30.0g×24%)/58.5=20/117mol,所以C=n/V=(20/117)÷(5/117)=4mol/L
(3)[(nx58.5)/(1000+nx58.5)]×100%=20%,解得n=4.3mol。
考点:考查物质的量浓度的相关计算。
本题难度:一般