|
高中化学知识点归纳《物质的量》高频试题预测(2019年最新版)(八)
2019-06-28 21:01:15
【 大 中 小】
|
1、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是: ( )
A.常温下,5.85gNaCl固体中含有NaCl分子数为0.1NA
B.标准状况下,22.4L水所含的原子数为3NA
C.标准状况下,4g氦气中所含的原子数为NA
D.0.5mol·L-1NaCl溶液中Cl-的物质的量为0.5mol
|
参考答案:C
本题解析:略
本题难度:一般
2、填空题 已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)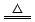 CuSO4+A↑+2H2O CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸? b.碱? c.盐? d.酸性氧化物? e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中__________(填写化学式,下同) 失去电子,氧化剂是____________。
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为_________L (假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:___________________ ??
计算反应后所得沉淀的质量为__________________g(保留到0.1g)。
参考答案:(12分) (1)d? SO2?KMnO4 (各1分)? (2)2.24?(2分)?
(3)Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓? (2分)
Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓(2分)? 4O5.9(3分)
本题解析:(1)A物质可以导致酸雨的形成。则A是二氧化硫,应该属于酸性氧化物;
A物质可以使酸性KMnO4溶液褪色,此反应中SO2?失去电子,氧化剂是KMnO4。
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,由定量关系得:Cu+2H2SO4(浓) CuSO4+SO2 ↑+2H2O,电子转移2mol,就会生成1molSO2 气体,所以生成的SO2 气体在标准状况下体积为2.24L (假设气体全部逸出)。 CuSO4+SO2 ↑+2H2O,电子转移2mol,就会生成1molSO2 气体,所以生成的SO2 气体在标准状况下体积为2.24L (假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。此过程发生的反应的离子方程式:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓反应后所得沉淀包括硫酸钡和氢氧化钡,由守恒关系可知其质量之和为4O5.9g。
点评:此题要熟悉基本的计算关系式,同时要注意离子方程式书写的方法。
本题难度:一般
3、选择题 在某温度下,NaOH的溶解度为20克,该温度下将80克NaOH放入220克水中,充分搅拌后,测的溶液的密度为1.2 g/mL ,则溶液中溶质的物质的量浓度为
[? ]
A. 0.02mol/L
B.? 2.0mol/L
C. 5.0 mol/L
D. 7.5mol/L
参考答案:C
本题解析:
本题难度:简单
4、填空题 (1)将质量比为14︰15的N2和NO混合,混合气体中N2和NO的物质的量之比为?;氮原子和氧原子的个数之比为?;该混合气体的平均摩尔质量为?。
(2)23.75g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为?;则MCl2的相对分子质量为?;M的相对原子质量为?。
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则(NOx)的摩尔质量为?;x的数值为?。
参考答案:(1)1︰1;? 3︰1;?(2)95g·mol-1;? 95;? 24(3)46g·mol-1;2
本题解析:略
本题难度:简单
5、选择题 a mol FeS与b mol FeO投入到V L、c mol·L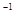 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(?) 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(?)
①(a+b)×63 g?②(a+b)×189 g
③(a+b) mol?④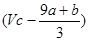 mol mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:根据铁原子守恒可知,硝酸铁的物质的量是(a+b)mol,则没有被还原的硝酸是3(a+b)mol,质量是3(a+b)mol×63g/mol=(a+b)×189 g,②正确;还原剂在反应中共失去(a+8a+b)mol电子,则根据电子的得失守恒可知,被还原的硝酸是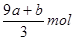 ,所以根据氮原子守恒可知,未被还原的硝酸是 ,所以根据氮原子守恒可知,未被还原的硝酸是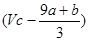 mol,④正确,答案选D。 mol,④正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,设计新颖,注重解题的灵活性,有利于培养学生分析问题、解决问题的能力,以及灵活应变能力。该题的关键是学会运用各种守恒法。
本题难度:一般
|