|
高中化学知识点归纳《氯及其化合物》考点巩固(2019年最新版)(八)
2019-06-28 21:01:36
【 大 中 小】
|
1、选择题 下列有关物质用途的说法中,不正确的是
A.漂白精能漂白是因为Ca(ClO)2中的 ClO-有强氧化性
B.明矾能够消毒杀菌是利用了胶体的吸附性
C.氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D.二氧化硅可用于制造光导纤维
参考答案:B
本题解析:
正确答案:B
B明矾能够净水是利用了胶体的吸附性,明矾不能消毒杀菌。
本题难度:简单
2、实验题 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
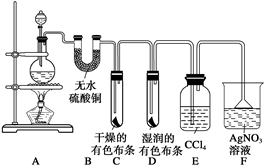
(1)下列方法中,可制得氯气的正确组合是?。
①MnO2和浓盐酸混合共热?
②KMnO4和浓盐酸混合?③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合?
A.①②③
B.①②④
C.①②
D.全部可以
| (2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是?。
(3)①装置B的作用是?,现象是?。
②装置C和D出现的不同现象说明的问题是?。
③装置E的作用是??
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。
参考答案:(1)D (2)浓盐酸随着反应的进行浓度逐渐降低,最终变为稀盐酸,反应不再产生氯气
(3)①证明有水蒸气产生 白色固体变蓝色
②氯气无漂白性,氯气与水反应产生的次氯酸有漂白性
③吸收氯气
(1)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2)Cl2+2NaClO2=2ClO2+2NaCl
本题解析:(1)MnO2、KMnO4、NaClO3、K2Cr2O7都具有强氧化性,与浓盐酸反应都能生成Cl2,故D项正确。
(2)浓盐酸随着反应的进行浓度逐渐降低,最终变为稀盐酸,反应不再产生氯气,HCl为0.2mol,所以生成的Cl2小于0.05mol,小于1.12L。
(3)①装置B中盛有无水硫酸铜,所起的作用为证明水蒸气的存在;现象为:白色固体变蓝色。
②装置D和E的区别在于布条是否干燥,而在湿润的布条中,氯气与水反应生成次氯酸,因此这两个装置说明了“氯气无漂白性,次氯酸有漂白性”。
③要检验有HCl挥发出来,需要除去Cl2,所以装置E的作用是:吸收氯气。
漂白粉长期放置于空气中,Ca(ClO)2与CO2、H2O反应生成HClO,HClO分解使漂白粉失效。
Cl2把NaClO2中的+3价Cl氧化为ClO2,配平可得化学方程式。
本题难度:一般
3、选择题 下列气体中,能污染大气,但不可以用碱溶液吸收的是( )
A.CO
B.Cl2
C.SO2
D.N2
参考答案:A.一氧化碳有毒,对大气有污染,但和碱不反应,所以不能用碱液吸收,故A选;
B.氯气有毒能污染大气,但能和碱反应生成无毒的氯化钠和次氯酸钠,所以能用碱液吸收,故B不选;
C.二氧化硫有毒能污染大气,但能和碱液反应生成亚硫酸钠,所以能用碱液吸收,故C不选;
D.大气无毒,对大气无污染,故D不选;
故选A.
本题解析:
本题难度:简单
4、填空题 氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O ?H++Cl-+ HClO,其平衡常数表达式为K=?。 ?H++Cl-+ HClO,其平衡常数表达式为K=?。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是?。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。
 
将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是?,处理从氯化塔中逸出气体的方法是?。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是?,其原因可能是?,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
参考答案:(1)[c(H+)·c(Cl-)·c(HClO)]/c(Cl2)
(2)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
充分接触(或充分吸收);用碱液吸收(或石灰乳或碱石灰或氢氧化钠溶液等)
(3)6OH-+3Cl2=5Cl-+ ClO3-+3H2O?反应放热使温度升高所致
本题解析:(1)K=[c(H+)·c(Cl-)·c(HClO)]/c(Cl2)
(2)熟石灰从塔顶喷洒从上向下,氯气从塔的最底层通入从下向上,氯气和熟石灰充分接触、混合,使其反应充分进行;氯气与碱反应,所以用碱液吸收;
(3)氯化塔设计为四层是为了增大散热面积,防止反应过程产生的热量使体系温度升高,副反应增多。
本题难度:一般
5、简答题 I.现有以下物质:①Cu;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤CuSO4;⑥固体NaOH;⑦CaO.
请回答下列问题(用序号填写):
其中:(1)能导电的是______(2)属于强电解质的是______(3)属于非电解质的是______
II.(1)胶体粒子的大小在______之间,可利用______(填物理性质)区别Fe(OH)3胶体和碘水.
(2)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为______,硫原子和氧原子个数之比为______.
(3)漂白粉是用Cl2与______(填化学式)反应来制取的,漂白粉是______(填“混合物”或“纯净物”),其有效成分为______,84消毒液的有效成分是______(以上两空均填化学式).
参考答案:I(1)Cu是金属单质,有能导电的自由电子;熔融的KNO3有自由移动的离子,能导电,故答案为:①④;
(2)熔融的KNO3;CuSO4;固体NaOH;CaO,能完全电离,属于强电解质,故答案为:④⑤⑥⑦;
(3)液态SO3的水溶液能导电,原因是SO3和水反应生成硫酸,硫酸能电离出自由移动的阴阳离子而使溶液导电,硫酸是电解质,SO3是非电解质;乙醇(C2H5OH)在水溶液里或熔融状态下都不能导电的化合物,属于非电解质,故答案为:②③;
II.(1)当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),Fe(OH)3胶体有丁达尔效应和碘水无丁达尔效应,故答案为:1-100nm;丁达尔现象;
(2)根据n=mM,SO2和SO3的物质的量之比为464:580=1:1,硫原子和氧原子个数之比为2:5,故答案为:1:1;2:5;
(3)漂白粉的制取原理为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;氢氧化钠溶液与氯气反应生成NaClO、NaCl、H2O,反应的化学方程式为:Cl2+2NaOH═NaClO+NaCl+H2O,
故答案为:Ca(OH)2;混合物;Ca(ClO)2;NaClO.
本题解析:
本题难度:一般
|