1、实验题 某无色透明的溶液,跟金属铝反应时,放出H2,试判断下列离子Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-在溶液中存在的情况有两种,分析后填写下表:
?
| 肯定存在
| 可能存在
| 肯定不存在
|
1
| ?
| ?
| ?
|
2
| ?
| ?
| ?
参考答案:(1) H+、SO42-;? Mg2+;? OH-、SO32-、HCO3-、Cu2+、Ba2+ Ag+、NO3-
(2) OH-、Ba2+;? NO3-; ? Mg2+、Cu2+、H+、Ag+、SO42-、SO32-、HCO3-
本题解析:复习巩固铝的化学性质——既能与酸反应又能与碱反应,复习离子共存的知识。适合于中等学生。根据铝的化学性质,与金属铝反应放出H2,有两种情况:酸溶液或强碱溶液。因此:(1)肯定存在H+、SO42-;Mg2+与题意不冲突,属可能存在的离子;SO32-、HCO3-、OH-与H+不共存,Ba2+、SO42-、SO32-不共存,Cu2+显蓝色,NO3-存在,则相当与硝酸溶液,而硝酸与金属反应一般不生成氢气而是NO,所以这些离子均肯定不存在。
(2)肯定存在OH-、Ba2+;NO3-与题意不冲突,属可能存在的离子;HCO3-、H+、Ag+、Mg2+与OH-不共存,SO42-、SO32-与Ba2+不共存,Cu2+有色,所以这些离子均肯定不存在。
本题难度:简单
2、选择题 下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中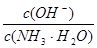 增大 增大
参考答案:B
本题解析:根据电荷守恒可知,A中应该是2c(SO42-)=c(NH4+),A不正确;醋酸是弱酸,所以pH=3的醋酸溶液的浓度对于0.001mol/L,因此反应后醋酸是过量的,溶液显酸性,B正确;C不正确,稀释促进电离,所以C中应该是c1>10c2,C不正确;D中,硫酸铵能抑制氨水的电离,溶液中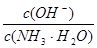 降低,答案选B。 降低,答案选B。
点评:在判断外界条件对平衡状态的影响是,应该依据勒夏特例原理进行有关的判断,因为该冶炼适用于所有的平衡体系。
本题难度:一般
3、选择题 叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3) >c(N3?)>c(H+)>c(OH?)
B.HN3与NH3作用生成的叠氮酸铵是离子化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+)
D.N3?与CO2含相等电子数
参考答案:A
本题解析:A、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-),是弱酸,一小部分电离,显酸性,不正确;B、HN3与作用生成的叠氮酸铵是共价化合物错误,生成物类似醋酸铵啊,是盐,并且是离子化合物;C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+),是弱酸HN3的酸根阴离子,所以在水中要水解,水解的程度较小,水解显碱性,是正确的;D、N3?与CO2含相等电子数,都是22,故正确。
点评:在高考中,考查化学基本概念和理论,是必考的知识点,一般而言,都是把基础的知识点,放在四个选项中,这样做覆盖内容多,面较大,只要理解好了基本的概念和理论,做起题目会相对简单些。
本题难度:一般
4、选择题 某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是
A.Cl
|
参考答案:
本题解析:
本题难度:简单
5、选择题 在含有CO32-且能使酚酞试液变红的无色溶液中,能大量共存的离子组是
A.Na+、SO32-、SO42-、K+
B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO4-、NO3-、Na+
D.K+、Ca2+、SO32-、Cl-
参考答案:A
本题解析:应注意题干中的信息:含CO32-且能使酚酞试液变红的无色溶液,B项中的Cu2+、C项MnO4-有颜色,排除;D项Ca2+与SO32-、CO32-反应生成沉淀,不能大量共存;B项离子不反应,可以大量共存。
本题难度:一般