1、选择题 下列说法正确的是?(?)
A.摩尔是一种国际基本物理量
B.标准状况下1摩尔SO3的体积约为22.4 L
C.常温常压下,11.2 LN2含有的分子数为0.5NA
D.在同温同压下,相同体积的任何气体单质所含分子数相同
参考答案:D
本题解析:摩尔是物质的量的单位,A错误,SO3在标准状况下为固体,不能用22.4L表示,B错误,常温常压下也不能用22.4L表示,C错误,D正确,答案选D。
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:简单
2、选择题 决定气体体积的因素是(?)
①气体分子的直径?②气体的物质的量多少
③气体分子间的平均距离?④气体分子的相对分子质量
A.①②
B.①③
C.②③
D.②④
参考答案:C
本题解析:考查影响气体体积的因素。由于气体分子间的距离远大于气体分子直径大小,所以决定气体体积的因素是气体的物质的量多少和气体分子间的平均距离,答案选C。
本题难度:简单
3、选择题 设NA代表阿伏加德罗常数的数值,下列说法正确的是(He:4;N:14;O:16)
A.1 mol·L-1的碳酸钠溶液中碳酸根离子数小于NA
B.常温常压下,4g氦气含有的气体分子数为2NA
C.二氧化锰与足量浓盐酸完全反应产生22.4L气体时,反应转移的电子数为2NA
D.二氧化氮和四氧化二氮组成的92g混合气体中含有4 NA 个氧原子
参考答案:D
本题解析:A:溶液体积未知,无法计算溶液中离子的量,排除
B:氦气为单原子分子,故4g氦气含有的气体分子数为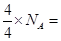 NA
NA
C:气体的状态未知,无法计算其物质的量,不正确
D:两气体分子的最简式均为NO2,即只要有46g混合物,其中一定含有2NA 个氧原子,正确
本题难度:简单
4、填空题 同温同压下,甲容器中所盛气体为CH4,乙容器中所盛气体为C2H2.
(1)若甲、乙两容器中所含氢原子数相等,则两容器所盛气体的体积之比为______.
(2)若甲、乙两容器中所含气体质量相等,则两容器所盛气体的分子数之比为______.
(3)若甲、乙两容器中所含体积相等,则两容器所盛气体的质量之比为______.
参考答案:(1)由n=NNA=VVm可知,同温同压下,气体的体积之比等于分子数之比等于物质的量之比,若甲、乙两容器中所含氢原子数相等,两容器所盛气体的分子数之比为1:2,则两容器所盛气体的体积之比为1:2,故答案为:1:2;
(2)设甲、乙两容器中所含气体质量为m,由n=NNA=mM可知:N=m?NAM,则两容器所盛气体的分子数之比与相对分子质量呈反比,所以:N(CH4):N(C2H2)=26:16=13:8,故答案为:13:8;
(3)由n=mM=VVm可知:m=V?MVm,即若甲、乙两容器中所含体积相等,则两容器所盛气体的质量之比与气体的相对分子质量呈之比,则m(CH4):m(C2H2)=16:26=8:13,故答案为:8:13.
本题解析:
本题难度:一般
5、选择题 同温同压下,等质量的CH4和SO2相比较,下列叙述正确的是( )
A.密度比是:4:1
B.体积比:4:1
C.原子个数比:5:3
D.分子数比:1:4
参考答案:A、由n=mM=VVm可知,ρ=mV=MVm,在相同条件下气体的密度之比等于相对分子质量之比,所以两种气体的密度之比等于16:64=1:4,故A错误;
B、由n=mM=VVm可知,同温同压下,等质量的CH4和SO2的体积与气体的相对分子质量呈反比,则体积之比为64:16=4:1,故B正确;
C、设气体的质量为m,则原子个数比为m16×5:m64×?3=20:3,故C错误;
D、由n=mM=NNA可知,等质量的CH4和SO2的分子数之比与气体的相对分子质量呈反比,则分子数之比为64:16=4:1,故D错误.
故选B.
本题解析:
本题难度:简单