1、选择题 经氯气消毒的自来水,若用于配置以下溶液:①NaOH?②AgNO3?③Na2CO3?④FeSO4?
⑤KI?⑥Na2S?⑦Na2SO3会使配置的溶液变质的是?(?)
A.全部
B.②④⑤⑥
C.②⑤
D.④⑥
参考答案:A
本题解析:略
本题难度:一般
2、选择题 下列关于氯气的叙述,正确的是( )
A.氯气是一种无色,没有刺激性气味的气体
B.氯气、氯水、液氯的成分相同
C.氯气不能与碱发生反应
D.氯气有毒,但可用来自来水的杀菌消毒
参考答案:A.氯气是黄绿色、有刺激性气味的气体,有毒,故A错误;
B.氯气的水溶液是氯水,属于混合物,氯气和液氯的成分是氯气,属于纯净物,故B错误;
C.氯气和碱反应生成氯化物、次氯酸盐和水,故C错误;
D.氯气有毒,能和水反应生成盐酸和次氯酸,次氯酸有强氧化性能杀菌消毒,所以可用来自来水的杀菌消毒,故D正确;
故选D.
本题解析:
本题难度:一般
3、填空题 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。?
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2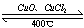 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
参考答案:(14分)(1)强氧化性(1分)? Cl2+2OH-=ClO-+Cl-+H2O(2分)
(2)2? 2? H2O? 2? 2? 1(水分子1分,系数1分,共2分)
(3)①2ClO-+SO2=2ClO2+SO42-(2分)?②1.6mol(2分)?③2:5(2分)
(4)32(2分)?强(1分)
本题解析:(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性。氯气能被氢氧化钠溶液吸收,所以工业上用氯气和NaOH溶液生产消毒剂NaClO,有关反应的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O。
(2)根据物质的化学式可知,反应前后元素化合价发生变化的是氯元素。其中部分氯元素的化合价从0价升高到+1价,部分降低到-1价,所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是2:1.根据原子守恒可知,反应前还有水参加,所以配平后的方程式是2 Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O.
(3)①KClO3与SO2在强酸性溶液中反应可制得ClO2,在反应中SO2被氧化生成硫酸钾,所以此反应的离子方程式为2ClO-+SO2=2ClO2+SO42-。
②ClO2遇浓盐酸会生成Cl2,则该反应的化学方程式是2ClO2+8HCl(浓)=4H2O+5Cl2↑。根据方程式可知反应中转移电子的个数是8个,所以每生成1mol Cl2转移电子的物质的量为8mol÷5=1.6mol。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-。在反应中氯元素的化合价从+4价降低到-1价,得到5个电子。Mn元素的化合价从+2价升高到+4价,失去2个电子,所以根据电子的得失守恒可知,该反应过程中氧化剂与还原剂的物质的量之比为2:5。
(4)设断开1 mol H-O键与断开1 mol H-Cl键所需能量分别是x与y,由于反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据题意可知4y+498kJ-2×243 kJ-4x=-115.6 kJ,解得x-y=32 kJ,因此H2O中H—O键比HC1中H—Cl键强。
本题难度:一般
4、填空题 (4分)古希腊流传这样一个传奇故事:一批贩运纯碱的商船停泊在江边的沙岸部,商人们找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体。你认为这种固体可能是____________,其主要成分是________________________。
参考答案:玻璃;Na2SiO3和SiO2
本题解析:略
本题难度:一般
5、选择题 往含有1.17 g NaCl和1.17 g NaF的溶液中加入过量的AgNO3溶液,将析出的沉淀过滤、洗涤、干燥,干燥后称量,其质量为2.87 g。根据此实验确定AgF在水中的溶解性应(?)
A.易溶于水
B.比AgCl更难溶于水
C.与AgCl一样难溶于水
D.无法确定
参考答案:A
本题解析:1.17 g NaCl与AgNO3溶液反应恰好生成2.87 g AgCl沉淀,所以NaF与AgNO3不反应。说明AgF易溶于水,实际上AgX在水中溶解度的顺序为:AgF>AgCl>AgBr>AgI。
本题难度:简单