?
参考答案:(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)?分液漏斗(2分) Mn2++Cl2↑+2H2O(2分)?分液漏斗(2分)
(2)2Cl2+2H2O+C CO2+4HCl(2分) CO2+4HCl(2分)
(3)①假设2:Cl-的浓度不够大(1分)假设3:Cl-和H+的浓度均不够大?(1分)
②(8分)
实验步骤
预期现象与结论
滴加几滴浓硫酸,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热。(2分)
①若淀粉-KI溶液变蓝,则假设1成立;
②若淀粉-KI溶液不变蓝,则假设2或假设3成立。(2分)
加入少量NaCl固体,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热。(2分)
①若淀粉-KI溶液变蓝,则假设2成立;②若淀粉-KI溶液不变蓝,结合步骤1的结论②,则假设3成立。(2分)
本题解析:本题考查了氯气的制取原理:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O
(1)制取氯气是固液加热的方式;一般用分液漏斗装液体,烧瓶做为反应容器。
(2)氯气在制取过程中只除去了HCl,并没有干燥,在加热条件下与C反应,产物为CO2和HCl,可知反应物为氯气、C和水
(3)探究氯气的制取原理:改变了盐酸的浓度,就可以从Cl-的浓度、H+的浓度对反应的影响进行假设、实验、验证。
本题难度:一般
2、选择题 下列物质在空气中久置变质,在变质过程中既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A.食盐
B.漂白粉
C.氯水
D.绿矾
参考答案:BD
本题解析:
【错解分析】考虑物质在空气中的变质,主要考虑物质自身的稳定性及是否与空气中的成分(主要是O2、CO2、H2O等)发生化学反应。
【正解】A项食盐很稳定,也不易与空气的成分发生反应。若为粗盐,因含MgCl2、CaCl2等杂质而易潮解,潮解是吸水过程,物理变化,不能称为变质。
B项主要成分是CaCl2和Ca(ClO)2。Ca(ClO)2可与空气中的CO2发生反应:Ca(ClO)2+CO2+H2O=CaCO3+2HCl,此非氧化还原反应;生成的HClO见光,有反应:2HCl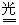 2HCl+O2↑。此为氧化还原过程。该变质过程符合题意。 2HCl+O2↑。此为氧化还原过程。该变质过程符合题意。
C项氯水的成分中HClO易见光分解,其变质仅有氧化还原反应。
D项绿矾可失水风化,为非氧化还原反应,而其中的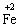 易被空气中的O2氧化成 易被空气中的O2氧化成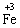 ,此过程为氧化还原反应,符合题意。此项为易漏选项。 ,此过程为氧化还原反应,符合题意。此项为易漏选项。
本题难度:简单
3、选择题 在一密闭容器中盛有a?L?Cl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为a?L.用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余.由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是( )
A.Cl2:H2=1
B.Cl2:H2<1
C.Cl2:H2≥1
D.Cl2:H2≤1
参考答案:因Cl2+H2?点燃?.?2HCl,反应前后体积不变,
用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余,
氢气与碱不反应,而氯气与碱反应,
则氯气的体积一定大于氢气的体积,
即Cl2:H2≥1,
故选C.
本题解析:
本题难度:一般
4、选择题 下列变化中,属于物理变化的是:①红磷加热升华变成白磷 ②氯化铵晶体受热后由试管底部移到试管上部 ③固体碘受热变成碘蒸气 ④干冰汽化 ⑤浓硝酸从无色液体变成黄色液体
A.①②
B.③④
C.④⑤
D.③④⑤
参考答案:B
本题解析:略
本题难度:简单
5、选择题 饱和氯水长期放置后,下列微粒数目在溶液中增多的是( )
A.Cl2
B.HClO
C.Cl-
D.H2O
参考答案:Cl2+H2O?HClO+HCl,但HClO也不稳定分2HClO=2HCl+O2↑,而随着HClO的分解,水中的Cl2+H2O?HClO+HCl平衡会向左移动,最终会变为盐酸,所以在溶液中增多的是Cl-,故选:C;
本题解析:
本题难度:简单
|