1、简答题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】
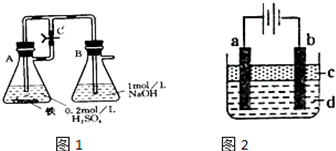
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行.最终在______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:______.
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀.请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水②NaCl溶液③NaOH溶液④四氯化碳⑤CuCl2溶液⑥乙醇⑦Fe棒⑧植物油⑨碳棒
a为______,b为______,c为______,d为______.(填序号)
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述
《化学辞典》,顾翼东编,1989年版P637
白色无定形粉末或白色至淡绿色六方晶体
与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花
《大学普通化学(下册)》傅鹰著P637
白色沉淀
此沉淀易被氧化成微绿色Fe3(OH)8
《普通化学教程》(下册)P788
白色
能强烈吸收O2,迅速变成棕色
Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+.
|
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:______;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成______.
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2?nH2O所致.用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势.加热时,“方法一”中弹簧夹C应处于______(填“打开”或“关闭”)状态,容器A中的反应须处于______(填“停止”或“发生”)状态.写出该实验中支持乙同学观点的化学方程式______.
参考答案:【实验设计】
方法一:关闭活塞C,A瓶内铁粉与稀硫酸反应放出的氢气不能排出而使瓶内气体增加,压强逐渐增大,把反应生成的硫酸亚铁溶液压入B瓶内,氢氧化钠与硫酸亚铁发生反应而生成氢氧化亚铁的沉淀,因此,在B瓶内观察到沉淀产生,涉及的反应有:Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+2H2O,
故答案为:B;Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+2H2O;
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀,则阳极上铁放电生成亚铁离子,所以铁作阳极,金属或导电的非金属作阴极,可以选用铁或石墨;
阴极上氢离子放电同时有氢氧根离子生成,所以可以选用氢氧化钠溶液或氯化钠溶液,为防止亚铁离子被氧化,则C的密度小于水的密度,所以C可以选用植物油,
故答案为:⑦;⑨或⑦;⑧;②或③;
【探究思考】
(1)由资料信息可知,氢氧化亚铁为白色而氢氧化铁为棕色,二者的混合物呈现出绿色,因此实验中出现灰绿色或绿色的现象应是生成的Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故;资料中提及的微绿色Fe3(OH)8,可理解为Fe(OH)2与Fe(OH)3的结合起的一种物质,其中既有+2价铁也有+3价铁,因此改写为氧化物的形式时,8个氢原子应结合成4H2O,所以应写成:FeO?Fe2O3?4H2O,
故答案为:由于F e(OH)2部分被氧化,混入少量的Fe(OH)3;FeO?Fe2O3?4H2O;
(2)验证乙同学的猜测要防止Fe (OH)2?nH2O被空气氧化,因此活塞C应处于打开状态,容器A中的反应也要继续进行,Fe (OH)2?nH2O受热分解生成氢氧化亚铁和水,
故答案为:打开;发生;Fe(OH)2?nH2O△.Fe(OH)2+nH2O.
本题解析:
本题难度:一般
2、简答题 Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:______.为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入______.(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是______.
(4)检验Fe3+存在的最佳试剂是______,现象是______.
(5)写出Fe与H20在一定条件下反应的化学方程式______.
参考答案:Fe(OH)2被氧化的化学方程为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(1)FeSO4溶液中亚铁离子易被氧化为三价铁离子,加入铁粉可以防止被氧化,故答案为:铁粉;
(2))氢氧化亚铁的制备要隔绝空气,除去蒸馏水中溶解的O2常采用加热至沸腾的方法,故答案为:铁粉;加热至沸腾;
(3)长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,可以防止空气随着NaOH溶液的加入进入溶液,故答案为:可以防止空气随着NaOH溶液的加入进入溶液;
(4)用KSCN来检验三价铁离子,现象为溶液变为血红色,故答案为:KSCN溶液;溶液变为血红色;
(5)Fe与H20在一定条件下反应的化学方程式:3Fe+4H20(g)?高温?.?Fe3O4+4H2,故答案为:3Fe+4H20(g)?高温?.?Fe3O4+4H2.
本题解析:
本题难度:一般
3、填空题 按要求进行书写:
(1)氯化钡的电离方程式:___________
(2)氢氧化亚铁在空气中被氧化的化学方程式:___________
(3)过氧化钠与水反应的化学方程式:___________
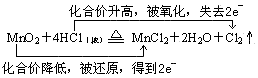
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
参考答案:(1)BaCl2 == Ba2+ + 2Cl-
(2)4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
(3)2Na2O2 + 2H2O == 4NaOH +O2↑
(4)
本题解析:
本题难度:一般
4、选择题 以下物质间的转化中,其中有不能通过一步反应实现的是
[? ]
A.Fe - FeCl2 - Fe(OH)2 - Fe(OH)3
B.Al - Al2O3 - Al(OH)3 - NaAlO2
C.S - SO2 -H2SO4 - MgSO4
D.N2 - NO - NO2 - HNO3
参考答案:B
本题解析:
本题难度:简单
5、填空题 甲、乙、丙三种物质之间有如?下转化关系: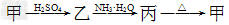
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。则甲是________,丙是________(填化学式)。写出“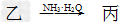 ”转化的离子方程式:______________________________。
”转化的离子方程式:______________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲是______,丙是________(填化学式)。写出“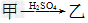 ”转化的离子方程式:____________________________。
”转化的离子方程式:____________________________。
参考答案:(1)Al2O3;Al(OH)3;Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(2)Fe2O3;Fe(OH)3;Fe2O3+6H+===2Fe3++3H2O
本题解析:
本题难度:一般