1、选择题 下列有关原电池和电解池的叙述中正确的是
A.钢管大部分浸在淡水中,主要发生析氢腐蚀
B.钢管若采用外加电流的阴极保护措施,应当与电源的正极相连
C.钢管若需保护,可采用牺牲阳极的阴极保护法
D.电解氯化钠溶液时电子从负极经过溶液流向正极
参考答案:C
本题解析:略
本题难度:一般
2、选择题 分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
参考答案:D
本题解析:A是锌的化学腐蚀,B和C中都是原电池,但由于金属性是镁>锌>锡,所以B中锌是正极被保护,属于牺牲阳极的阴极保护法。C中锌是负极,加快腐蚀。D中是电解池,锌和电源的负极相连,做阴极,被保护,属于外加电流的阴极保护法,因此腐蚀最慢的是D,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,难度不大。该题的关键是明确金属腐蚀和防护的原理,然后结合题意具体问题、具体分析即可。
本题难度:一般
3、选择题 (15分)
Ⅰ.(6分)光合作用是由二氧化碳与水合成葡萄糖,同时放出氧气。设想将该反应倒过来,可设计成一个原电池,产生电流,这样就将太阳能转变成了电能。
(1)写出该原电池的总反应式:______________________________________
(2)写出该电池在酸性介质中放电的电极反应式:
负极:_____________________________________________
正极:_____________________________________________
Ⅱ.(6分)类比思维是学习化学的重要方法,但结果是否正确必须经受检验。在进行类比思维的时候,不能机械类比,一定要注意一些物质的特殊性,以防止类比出错误的结论。凭已有的化学知识,下列类比结果正确的是:(填标序号)?。若错误,在其后写出正确的。
①在相同条件下,Na2CO3溶解度比NaHCO3大
类比:在相同条件下,CaCO3溶解度比Ca(HCO3)2大
正确的应该为(若类比正确,此处不写,下同。):?。
②向次氯酸钙溶液中通过量CO2:CO2 + ClO- + H2O = HCO3- + HClO
类比:向次氯酸钠溶液中通过量SO2:SO2 + ClO- +H2O = HSO3- + HClO
正确的应该为:?。
③根据化合价Fe3O4可表示为:FeO·Fe2O3?类比:Fe3I8也可表示为FeI2·2FeI3
正确的应该为:?。
④CaC2能水解:CaC2+2H2O =Ca(OH)2 + C2H2↑
类比:Al4C3也能水解:Al4C3 + 12H2O = 4Al(OH)3↓+ 3CH4↑
正确的应该为:?。
Ⅲ.(3分)常温下,某水溶液M中存在的离子有:Na+ 、A-、H+、OH-。若该溶液M由 pH=3的HA溶液
、A-、H+、OH-。若该溶液M由 pH=3的HA溶液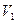 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液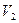 mL混合反应而得,则下列说法中正确的是?(填字母)。
mL混合反应而得,则下列说法中正确的是?(填字母)。
A.若溶液M呈中性,则溶液M中C(H+)+C(OH-)=2×10-7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
参考答案:(15分)
Ⅰ.(6分)
(1)C6H12O6+6O2 6CO2+6H2O(2分)
6CO2+6H2O(2分)
(2)C6H12O6+6H2O-24e-= 6CO2+24H+(2分) 6O2+24e-+24H+= 12H2O(2分)
Ⅱ.(6分)④(1分)
①在相同条件下,CaCO3溶解度比Ca(HCO3)2小(1分)
② ClO-?+ SO2 + H2O ==SO42- + Cl-?+ 2 H+(2分)③3FeI2·I2(2分)
Ⅲ.(3分)AD
本题解析:略
本题难度:一般
4、选择题 在一些特定的条件下,铁也可以生成具有保护作用的氧化膜。例如,铁在浓硝酸、浓硫酸中可以生成氧化膜(称为钝化膜),在碱性溶液中也易被一些并不强的氧化剂氧化生成钝化膜。拿一把已除锈、去油的小刀放入发蓝液(50 g氢氧化钠、10 g硝酸钠、3 g亚硝酸钠和100 mL水所形成的溶液)中,加热煮沸20 min,就可形成蓝黑色的“烤蓝”。根据上面的信息判断下列叙述不正确的是
[? ]
A.在烤蓝的过程中,铁没有损失
B.烤蓝实质是一部分铁被氧化成致密的氧化膜,起到了抗腐蚀作用
C.在“烤蓝”液中硝酸钠、亚硝酸钠起了氧化剂作用
D.在烤蓝前除锈可以使用盐酸
参考答案:A
本题解析:
本题难度:一般
5、填空题 (14分)请根据所学的电化学原理,解决以下问题。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s) 设计的双液原电池,可以提供稳定的电流。装置如图所示,其中盐桥中装有琼脂—饱和KCl溶液。

回答下列问题:
①电极X的材料和电解质溶液Y分别为?;
②盐桥中K+移向?(填A或B);
③银电极发生的电极反应为?。
(2)下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
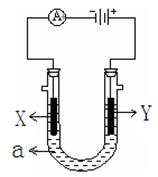
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,?(填X或Y)电极附近先变红色, X极上的电极反应式为?。
②若要在铁制品上镀一定厚度的Cu层,Y电极反应式为?
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是?;
参考答案:( 14分)(每空2分)
(1)①Cu、AgNO3溶液?②B?③Ag+?+ e- = Ag?
(2)①X? 2H2O +2e-=H2↑+OH-(或2H++ 2e- =H2↑ )?
②Cu - 2e- =Cu2+?③64
本题解析:(1)①在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应 。根据总反应式可知,铜失去电子,所以铜是负极,即X是铜。银离子得到电子,所以正极溶液中电解质是硝酸银溶液。
②原电池阳离子向正极移动,即K+移向B。
③银电极是正极,溶液中的银离子得到电子,方程式为Ag+?+ e- = Ag。
(2)①惰性电极电解饱和氯化钠溶液,阴极是氢离子放电,从而破坏阴极周围水的电离平衡,所以阴极周围溶液显碱性,溶液显红色。根据装置图可知,X与电源的负极相连,做阴极,所以电极反应式为2H++ 2e- =H2↑ 。
②电镀时,待镀金属作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电解质溶液。根据装置图可知,Y与电源的正极相连,作阳极,所以是铜,电极反应式为Cu - 2e- =Cu2+。
③1.12 L氯气时(标准状况)是0.05mol,转移电子是0.05mol×2=0.1mol,所以根据电子得失守恒可知,金属的相对原子质量是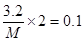 ,解得M=64。
,解得M=64。
本题难度:一般