1、选择题 下列大小关系正确的是
A.熔点:NaI>NaBr
B.硬度:MgO>CaO
C.晶格能:NaClD.熔沸点:CO2>NaCl
参考答案:B
本题解析:选项ABC都是离子晶体,形成离子晶体的离子键越强,熔沸点的越高,硬度越大。形成离子键的离子半径越小,电荷数越多,离子键越强,所以选项AC不正确,B正确。D中CO2是分子晶体,熔沸点低于离子晶体氯化钠的,答案选B。
本题难度:困难
2、填空题 如图所示是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h②b、g、k③c、h、l④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子所需要的能量主要受两大因素的影响:A.原子核对核外电子的吸引力;B.形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ/mol)。
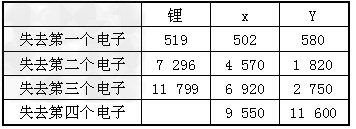
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子时所需的能量________。
②表中X可能为以上13种元素中的________(填写字母),它与j元素形成的化合物化学式为_____________。
③Y是周期表中的________族的元素。
④以上13种元素中,____(填写字母)元素原子失去核外第一个电子需要的能量最多。
参考答案:(1)①④
(2)①Li;原子失去1个电子后形成稳定结构,再失去1个电子很困难
②aNa2O或Na2O2;③ⅢA;④m
本题解析:
本题难度:一般
3、选择题 短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期.X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列比较正确的是( )
A.气态氢化物的稳定性:Z<Y<X
B.最高价氧化物水化物酸性:Z>Y
C.原子半径:Z<Y<X
D.元素非金属性:Z>Y>X
参考答案:短周期元素X、Y、Z,X原子的最外层电子数是其电子层数的3倍,X原子含有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一主族,则Y为硫元素;Y、Z位于同一周期,Z原子的核外电子数比Y原子少1,则Z核外电子数为15,故Z为磷元素.
A、同周期随原子序数增大非金属性增强,所以非金属性P<S,同主族自上而下非金属性减弱,所以非金属性S<O,所以非金属性O>S>P,非金属性越强氢化物越稳定,所以氢化物稳定性Z<Y<X,故A正确;
B、非金属性S>P,非金属性越强最高价氧化物水化物酸性越强,即最高价氧化物水化物酸性Y>Z,故B错误;
C、同周期随原子序数增大原子半径减小,所以原子半径P>S,同主族自上而下原子半径增大,故原子半径S>O,所以原子半径X<Y<Z,故C错误;
D、同周期随原子序数增大非金属性增强,所以非金属性P<S,同主族自上而下非金属性减弱,所以非金属性S<O,所以非金属性X>Y>Z,故D错误.
故选:A.
本题解析:
本题难度:简单
4、填空题 已知X和Y均是元素周期表中同一主族元素的单质,W、V是化合物,它们有如下反应:(式中各物质的化学计量数及反应条件均已略去)X+W→Y+V。
试写出符合题意且满足下列要求的化学方程式:
① W是H2O:______________________________
②V的水溶液是酸:____________________________
③W、V都是氧化物:________________________________
④V是水:_______________________________
参考答案:(1)2Na+2H2O=2NaOH+H2 ↑
(2)Cl2+2HBr=Br2+2HCl?(或其他合理答案)?
(3)2C+SiO2 2CO↑+ Si?
2CO↑+ Si?
(4)O2+2H2S=2S↓+2H2O
本题解析:
本题难度:一般
5、选择题 下列物质性质递变正确的是( )
A.原子半径:C、Al、K依次增大
B.热稳定性:HF、NH3、SiH4依次增强
C.水化物的酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱
D.非金属性:Cl、P、S依次增强
参考答案:A.C核外有2个电子层,电子层数最小,则半径最小,K原子核外有4个电子层,电子层数最多,半径最大,则有原子半径:C、Al、K依次增大,故A正确;
B.非金属性:F>N>Si,元素的非金属性越强,对应的氢化物越稳定,则有:热稳定性:HF、NH3、SiH4依次减弱,故B错误;
C.金属性:Na>Mg>Si,元素的金属性越强,对应最高价氧化物的水化合物的碱性越强,则有NaOH、Mg(OH)2、Al(OH)3碱性减弱,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,则非金属性:Cl、P、S依次减弱,故D错误.
故选A.
本题解析:
本题难度:简单