1、选择题 下列分子的空间构型是正四面体形的是
[? ]
A. CH4
B. NH3
C. H2O
D. C2H4
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列物质的熔、沸点高低顺序中排列正确的是 ( )
A.金刚石>晶体硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O
D.金刚石>生铁>纯铁>钠
参考答案:B
本题解析:选项A中形成的都是原子晶体,形成原子晶体的原子半径越小,共价键越强,晶体的熔、沸点越高,正确的顺序应该是金刚石>碳化硅>晶体硅,所以选项A不正确;选项B中形成的晶体都是分子晶体,其熔、沸点与分子间作用力有关系,而分子间作用力大小与相对分子质量大小有关系,所以选项B正确;氧化镁是离子晶体,而另外三种都是分子晶体,但由于水分子中存在氢键,所以水的熔、沸点高于氧气和氮气的,所以选项C不正确;合金的熔点一般低于其成分金属的熔点,正确的顺序应该是金刚石>纯铁>生铁>钠,所以选项
D不正确。
本题难度:一般
3、选择题 共价键、离子键和范德华力都是粒子之间的不同作用力,下列物质同时含有上述两种作用力的组合是( )?
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷?
A.①②④
B.①③⑥
C.②④⑥
D.③④⑤?
参考答案:B?
本题解析:Na2O2中Na+与O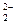 之间以离子键结合,O
之间以离子键结合,O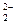 中O—O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以分子间作用力结合,符合条件;白磷(P4)分子内P—P以共价键结合,而P4分子之间以分子间力结合,也符合题意;SiO2、金刚石只有共价键,为原子晶体,NaCl中只有离子键。?
中O—O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以分子间作用力结合,符合条件;白磷(P4)分子内P—P以共价键结合,而P4分子之间以分子间力结合,也符合题意;SiO2、金刚石只有共价键,为原子晶体,NaCl中只有离子键。?
本题难度:一般
4、选择题 下列物质固态时一定是分子晶体的是(?)
A.酸性氧化物
B.碱性氧化物
C.含氧酸
D.非金属单质
参考答案:C
本题解析:酸性氧化物在固态时可以是原子晶体,例如二氧化硅为原子晶体,故A错误;碱性氧化物在固态时一般是离子晶体,例如氧化钙、氧化钡,故B错误;含氧酸在固态时一定是分子晶体,故C正确;非金属单质在固态不一定为分子晶体,例如石墨为混合型晶体,B为原子晶体,故D错误。
点评:本题考查了分子晶体,属于对化学基本知识的考查,本题要掌握的是二氧化硅为酸性氧化物,但是其为原子晶体,本题难度中等。
本题难度:一般
5、选择题 最近意大利罗马大学的Fulvio Cacace等科学家获得了具有理论研究意义的N4分子,其结构与白磷相似,
1个N4分子的4个氮原子位于正四面体的4个顶点,如图所示。下列关于N4的说法中正确的是
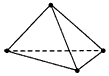
[? ]
A.N4是一种新型的化合物
B.N4与N2互为同素异形体
C.N4比N2更稳定
D.N4转化为N2属于物理变化
参考答案:B
本题解析:
本题难度:简单