1、判断题 有X、Y、Z三种元素,已知①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用。
(1)推断X、Y、Z三种元素的名称为:X.________,Y._______,Z._______。
(2)化合物的化学式:XZ_______,X2Y_______。
(3)五个过程中涉及的化学反应的方程式为________、________、________。
参考答案:
(1)氢 氧 氯 (2)HCl H2O (3)H2+Cl 2HCl? 2H2+O2
2HCl? 2H2+O2 2H2O? Cl2+H2C====HCl+HClO
2H2O? Cl2+H2C====HCl+HClO
本题解析:
抓住明显特征,入手分析可得答案。如:“火焰为苍白色”可推知是H2在Cl2中燃烧(或Cl2在H2中燃烧)。由③可推出X+是H+、Z-是Cl-。根据④的描述,可认为是H2和O2的反应。根据⑤可知有HClO生成。
本题难度:一般
2、选择题 从人类健康或生活实际的角度考虑,下列叙述正确的是
A.用铝锅炒菜比用铁锅好
B.氯气泄漏后应顺风向低处跑
C.用SO2漂白食品不影响人类健康
D.食用“加碘”食盐有利于健康
参考答案:D
本题解析:人体摄入过多的铝,会影响人的身体健康,易引起老年痴呆症,A错;氯气泄漏后应逆风向高处跑,B错;用SO2漂白食品,对人体的肝、肾脏等有严重的损害,并有致癌作用,C错。
本题难度:简单
3、选择题 实验室制取氯气,常用排饱和食盐水的方法收集,原因是
A.可产生更多的氯气
B.只有饱和食盐水才能除去HCl杂质
C.既能除去HCl,又能防止Cl2的溶解
D.食盐水易得到
参考答案:C
本题解析:氯气在饱和食盐水中溶解度降低,同时又可溶解HCl。
本题难度:简单
4、选择题 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计(? )
A.甲=乙>丙
B.甲>丙>乙
C.丙>甲=乙
D.乙>丙>甲
参考答案:B
本题解析:氯水中存在下列平衡:Cl2+H2O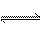 HCl+HClO。甲中加入NaHCO3后,NaHCO3会与酸反应。而酸性:HCl>H2CO3>HClO,所以NaHCO3先与HCl反应而不与HClO反应,由于平衡中HCl被消耗,平衡移动的原理,平衡向右移动,反应继续生成HClO,HClO浓度增大。另外HClO具有强氧化性,乙瓶中,HClO可将NaHSO3氧化,所以HClO浓度下降。丙瓶中HClO浓度不变。
HCl+HClO。甲中加入NaHCO3后,NaHCO3会与酸反应。而酸性:HCl>H2CO3>HClO,所以NaHCO3先与HCl反应而不与HClO反应,由于平衡中HCl被消耗,平衡移动的原理,平衡向右移动,反应继续生成HClO,HClO浓度增大。另外HClO具有强氧化性,乙瓶中,HClO可将NaHSO3氧化,所以HClO浓度下降。丙瓶中HClO浓度不变。
点评:本题在一个新的情景下对次氯酸的性质进行了考查,难度不大,但是需要学生全面把握,综合考虑。
本题难度:一般
5、选择题 向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是(?)
A.KCl
B.NaCl和KCl
C.NaCl和KBr
D.NaCl、KCl和I2
参考答案:B
本题解析:通入过量Cl2,发生反应2NaBr+Cl2====2NaCl+Br2,2KI+Cl2====2KCl+I2,蒸干灼烧时Br2挥发,I2升华。
本题难度:简单