1、选择题 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关,下列各组物质:①Cu与浓硝酸;②Fe与浓硫酸;③Na与氧气;④P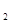 O
O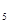 与水,由于反应温度不同而能发生不同氧化还原反应的是:(? )
与水,由于反应温度不同而能发生不同氧化还原反应的是:(? )
A.②③④
B.①②③
C.②③
D.③④
参考答案:C
本题解析:铜与硝酸的反应,和硝酸的浓度有关,与温度无关。常温下,铁和浓硫酸会发生钝化,在加热的条件下,才能生成硫酸铁、SO2和水。钠和氧气反应,不加热,生成氧化钠,加热生成过氧化钠。P2O5和冷水反应生成偏磷酸HPO3,和热水反应生成磷酸H3PO4。但该反应不是氧化还原反应,所以正确的答案是C。
本题难度:一般
2、选择题 稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。
已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是( )
A.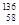 Ce、
Ce、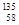 Ce、
Ce、 Ce、
Ce、 Ce它们互称为同素异形体
Ce它们互称为同素异形体
B.工业上可以采用电解氯化铈水溶液来获得铈单质
C.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑
D.工业上金属铈一般保存在敞口容器中
参考答案:C
本题解析:A互为同位素,错误;铈与水、空气反应,B、D错误;由信息可知Ce4+>Fe3+,铁与酸反应时不能被H+氧化成Fe3+,所以H+也不能把Ce氧化成Ce4+,即Ce与非氧化性酸反应生成Ce3+,C正确。
本题难度:一般
3、选择题 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O?2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
参考答案:A.由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故A错误;
B.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,溶液pH值不变,故B错误;
C.H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,故C正确;
D.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选CD.
本题解析:
本题难度:简单
4、选择题 已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2
B.2NaZ+Y2=2NaY+Z2
C.2NaY+W2=2NaW+Y2
D.2NaZ+X2=2NaX+Z2
参考答案:A.该反应中,氧化性Z2>W2,与已知不符合,所以不能发生,故A不选;
B.该反应中,氧化性Y2>Z2,与已知不符合,所以不能发生,故B不选;
C.该反应中氧化性W2>Y2,与已知相符,所以能发生,故C选;
D.该反应中氧化性X2>Z2,与已知不符合,所以不能发生,故D不选;
故选C.
本题解析:
本题难度:简单
5、实验题 (13分)已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸。
(1)请写出碘元素在周期表的位置:第五周期 族。
(2)将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能
有 气体。
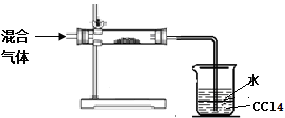
(3)小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究。他设计了如右实验装置图初步探究设计:
①其中直形玻璃管中所装的药品是 (写名称)
②足量四氯化碳的两个作用是: , 。
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2。
③小明拟对溶在水层的其它混合气体成分做进一步探究。请你从以下限选试剂中选择合适的试剂帮小明完成实验报告。
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1mol/L HNO3、淀粉溶液、BaCl2溶液
实验方案
| 可能的现象和相应的结论
|
取少量烧杯中的上层溶液分装入A、B两支试管中
|
|
|
|
|
|
参考答案:(1) VIIA(1分) (2) SO2(2分)
(3) ①无水硫酸铜(2分) ②检验、吸收碘蒸气;防倒吸(3分,每个1分) ③(答案合理便给分)
实验方案
可能的现象和相应的结论
往A试管中加入少量品红溶液(1分)
若品红溶液褪色,则原混合气体中有SO2
若溶液不褪色,则原混合气体中没有SO2(1分)
往B试管中滴加足量硝酸溶液后(1分),再滴入少量淀粉溶液(1分)
若淀粉溶液变蓝,则原混合气体中有HI
若溶液不变蓝,则原混合气体中没有HI(1分)
本题解析:(1)碘的原子序数是53,因此碘元素在周期表的位置是第五周期第VIIA族。
(2)由于浓硫酸具有氧化性,而碘化氢具有还原性,能被浓硫酸氧化生成单质碘,硫酸被还原为SO2,所以将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能有SO2气体。
(3)①由于气体通过溶液时会带出水蒸气,所以首先检验水蒸气,一般用五水硫酸铜,即其中直形玻璃管中所装的药品是无水硫酸铜。
②碘能被四氯化碳萃取,又因为碘化氢极易溶于水,所以足量四氯化碳的两个作用是检验、吸收碘蒸气和起防倒吸作用。
③由于上层溶液中溶解的是碘化氢和SO2,检验SO2可以用品红溶液。又因为氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2,所以检验碘离子应该用稀硝酸,因此实验方案可设计为
实验方案
可能的现象和相应的结论
往A试管中加入少量品红溶液(1分)
若品红溶液褪色,则原混合气体中有SO2
若溶液不褪色,则原混合气体中没有SO2(1分)
往B试管中滴加足量硝酸溶液后(1分),再滴入少量淀粉溶液(1分)
若淀粉溶液变蓝,则原混合气体中有HI
若溶液不变蓝,则原混合气体中没有HI(1分)
考点:考查物质性质实验方案设计与探究
本题难度:一般