1、实验题 食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: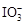 ?>Fe3+>I2;还原性:
?>Fe3+>I2;还原性: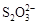 >I-;②KI+I2
>I-;②KI+I2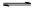 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有?(用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
?
| 0.01mol·L-1KIO3
酸性溶液(含淀粉)
的体积/mL
| 0.01mol·L-Na2SO3
溶液的体积/mL
| H2O的
体积/mL
| 实验
温度
/℃
| 溶液出现
蓝色时所
需时间/s
|
实验1
| 5
| V1
| 35
| 25
| t1
|
实验2
| 5
| 5
| 40
| 25
| t2
|
实验3
| 5
| 5
| V2
| 0
| t3
|
?
表中数据:t1?t2(填“>”、“<”或“=”);表中V2=___________mL
2、选择题 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO +4H+
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4