1、选择题 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
Fe2O3+3KNO3+4KOH  ?2K2FeO4+3KNO2+2H2O。下列说法正确的是
?2K2FeO4+3KNO2+2H2O。下列说法正确的是
A.该反应是非氧化还原反应
B.KNO3是还原剂
C.生成1mol K2FeO4转移的电子数为4 mol
D.K2FeO4不仅具有杀菌消毒作用,而且具有净水作用
参考答案:D
本题解析:根据方程式可知,Fe的化合价从+3价升高到+6价,失去3个电子,作还原剂;N元素的化合价从+5价降低到+3价,得到2个电子,作氧化剂,ABC是错误的。高铁酸钾具有强氧化性,能杀菌消毒,其还原产物Fe3+在溶液中水解生成氢氧化铁胶体,具有吸附性,能起净水剂的作用,所以正确的答案选D。
本题难度:一般
2、选择题 将少量SO2通入Fe2(SO4)3溶液中发生反应:SO2+2Fe3++2H2O = SO42-+2Fe2++4H+;然后再加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O。下列判断正确的是
A.还原性Cr3+> Fe2+> SO2
B.氧化性Cr2O72-> SO2> Fe3+
C.两个反应中Fe2(SO4)3均作还原剂
D.Cr2O72-能将SO2氧化成SO42-
参考答案:D
本题解析:在氧化还原反应中氧化剂的氧化性大于氧化产物的,还原剂的还原性大于还原产物的。所以氧化性是Cr2O72- > Fe3+> SO2,还原性是Cr3+< Fe2+< SO2。在第一个反应中硫酸铁是氧化剂,在第二个反应中硫酸铁是氧化产物,所以选项D是正确的,答案选D。
本题难度:简单
3、填空题 1. 根据反应8NH3+3Cl2 = 6NH4Cl+N2,回答下列问题。
(1)还原剂是?(填化学式)。
(2)氧化剂与氧化产物的质量比为(填整数比)?。
(3)当生成28g N2时,被氧化的物质有?克。
(4)该反应发生还原反应的过程可以表示为Cl2+2e- = 2Cl-(或3Cl2+6e- = 6Cl-),则发生氧化反应的过程可表示为?。
参考答案:
1、(1)? NH3 ?(2)? 213:28?(3)? 34?(4)8NH3-6e-=6NH4++N2
本题解析:(1)根据方程式可知,氨气中氮元素的化合价升高,被氧化,所以氨气是还原剂。
(2)氧化剂是氯气,而氧化产物是氮气,所以二者的质量之比是3×71︰28=213︰28。
(3)28g氮气是1mol,所以被氧化的氨气是2mol,质量是2mol×17g/mol=34g。
(4)根据电子的得失守恒可知,总反应式减去3Cl2+6e- = 6Cl-即得到氧化反应的反应式,所以应该是8NH3-6e-=6NH4++N2。
点评:在进行氧化还原反应的有关判断时,关键是准确标出有关元素的化合价。而在进行计算是有关利用电子的得失守恒。
本题难度:一般
4、填空题 高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知: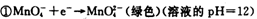
②
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为?(填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):
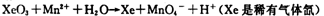
已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为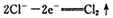
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是?。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式?。
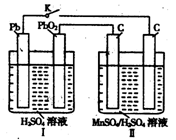
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为?。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为?,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为?,MnO2的理论产量为?g。
参考答案:(14分,每空2分)(1)MnO2?(2)无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)
(3)2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O
(4)Mn2+-2e-+2H2O=MnO2+4H+? Pb+PbO2+2H2SO4=2PbSO4+2H2O? 2mol? 87
本题解析:(1)根据反应①②可知,在碱性溶液中MnO4-被还原生成物是MnO42-,在酸性溶液中MnO4-被还原生成物是Mn2+,即溶液的酸性越强,还原产物中Mn的化合价越低,所以在中性溶液中,MnO4-被还原生成物是MnO2。
(2)根据已知反应可知,XeO3能把Mn2+氧化生成MnO4-。又因为氯离子的还原性强于Mn2+的还原性,所以反应中还有氯气生成,因此可能观察到的现象是无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)。
(3)草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去,这说明草酸具有还原性,能被酸性高锰酸钾溶液氧化生成CO2,所以反应的离子方程式是2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O。
(4)电解池中阳极失去电子,发生氧化反应,则Mn2+在阳极失去电子,发生氧化反应,因此阳极电极反应式是Mn2+-2e-+2H2O=MnO2+4H+。铅蓄电池中负极是Pb,正极是PbO2,所以铅蓄电池的总反应方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。所以根据方程式可知,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为2mol。根据电子得失守恒可知,阳极生成1mol MnO2,质量是87g。
本题难度:一般
5、选择题 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
[? ]
A.NO2
B.NO
C.N2O
D.N2
参考答案:C
本题解析:
本题难度:一般