1、实验题 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题
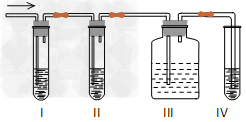
(1)I、II、III、IV装置可盛放的试剂是I?____;II_____;III_____;IV______(将下列有关试剂的序号填入空格内)。
A.品红溶液?B.NaOH溶液?C.浓硫酸?D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是__________________。
(3)使用装置II的目的是__________________。
(4)使用装置III的目的是____________________。
(5)确定含有乙烯的现象是______________________。
参考答案:(1)I?A;IIB;IIIA;IVD
(2)装置I中品红褪色
(3)除去SO2以免干扰乙烯的检验
(4)检验SO2是否被完全除去
(5)装置III中品红不褪色,装置IV中酸性KMnO4溶液褪色
本题解析:
本题难度:一般
2、简答题 有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、NaSO4.将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象.则A是______,B是______,C是______.
参考答案:H2SO4与K2CO3反应产生CO2气体,与BaCl2反应生成BaSO4白色沉淀,与NaSO4不反应,无现象,A产生白色沉淀,说明A为BaCl2,B产生无色气体,说明B为BaCl2,C中无明显现象,说明C为NaSO4,
故答案为:BaCl2;K2CO3;NaSO4.
本题解析:
本题难度:一般
3、选择题 有a、b、c、d四瓶无色稀溶液,分别是Ba(OH)2溶液、NaHCO3溶液、MgCl2溶液、稀H2SO4中的某一种.现各取少量溶液两两混合,?实验现象如表所示,表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象.下列推断不正确的是
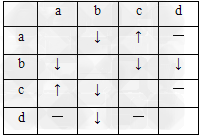
[? ]
A.c一定是稀H2SO4
B.b一定是Ba(OH)2?溶液
C.a可能是NaHCO3溶液
D.d一定是MgCl2溶液
参考答案:A
本题解析:
本题难度:一般
4、选择题 做焰色反应实验所用的铂丝,每次用毕后都要( )
A.用水多洗几次
B.先用稀盐酸洗,再用水洗
C.用稀盐酸洗,再在火焰上灼烧到没有颜色为止
D.放在火焰上灼烧,直到铂丝发红为止
参考答案:C
本题解析:
本题难度:一般
5、简答题 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
(1)该溶液中肯定含有的阳离子是______,且这些阳离子的物质的量之比为______;肯定不含的阳离子离子是______.
(2)还有一种阳离子可能存在,写出检验这种离子的实验方法及现象:______.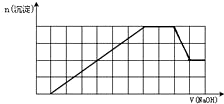
参考答案:(1)根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含碳酸根离子和镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+;溶液中电荷守恒判断阴离子只能含有SO42-;根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了1体积的氢氧化钠,所以形成氢氧化铝用了3体积的氢氧化钠,还有3体积的氢氧化钠一定是被三价铁离子消耗,原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,中和氢离子用了1体积氢氧化钠,过程中与铵根离子反应有了2体积氢氧化钠,依据图象中 的定量关系计算写出物质的量之比,H+、NH4+、Fe3+、Al3+物质的量之比为1:2:1:1,
故答案为:H+、NH4+、Fe3+、Al3+;1:2:1:1;Mg2+;
(2)根据溶液中的离子的存在情况可知道,钾离子不一定存在,利用焰色反应分析判断,焰色反应透过蓝色钻玻璃观察到火焰呈紫色,证明含有无紫色证明无钾离子,
故答案为:焰色反应,透过蓝色钻玻璃观察到火焰呈紫色.
本题解析:
本题难度:一般