1、简答题 Ⅰ.实验室配制1mol/LNa2CO3溶液250ml.
(1)需要固体Na2CO3______g;
(2)该溶液中的阳离子数目为______个;
(3)需要物质的量浓度为5mol/L的Na2CO3溶液______ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为______L.
(5)配制该溶液的操作顺序是(用字母表示,不重复使用)______.
A.称量B.洗涤C.定容D.溶解E.摇匀F.转移
Ⅱ.现有四种可溶性盐,其阳离子分别是K+、Ba2+、Fe3+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.小华同学说,不用做实验就可以确定这四种盐,那么他确定的四种盐的化学式分别为:______.
参考答案:Ⅰ.1mol/LNa2CO3溶液250mL,含有溶质的物质的量为:1mol/L×0.25L=0.25mol,
(1)配制1mol/LNa2CO3溶液250mL,需要碳酸钠的质量为:106g/mol×0.25mol=26.5g,故答案为:26.5g;
(2)0.25mol碳酸钠中含有0.5mol钠离子,该溶液中的阳离子数目为N(Naa+)=0.5NA,故答案为:0.5NA;
(3)需要物质的量浓度为5mol/L的Na2CO3溶液体积为:0.25mol5mol/L=0.05L=50mL,故答案为:50;
(4)0.25mol碳酸钠与足量盐酸反应,根据碳原子守恒,生成了0.25mol二氧化碳,标况下二氧化碳的体积:22.4L/mol×0.25mol=5.6L,故答案为:5.6L;
(5)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确顺序为ADFBCE,故答案为:ADFBCE;
Ⅱ.四种可溶性盐,其阳离子为:K+、Ba2+、Fe3+、Ag+,阴离子为:Cl-、SO42-、CO32-、NO3-,由离子共存可知:Ag+离子只能与NO3-离子结合形成AgNO3、则Ba2+只能与剩下的离子中Cl-结合生成BaCl2、Fe3+只能与SO42-、形成可溶性Fe2(SO4)3 ,最后剩下两种离子结合形成K2CO3,
所以以上离子之间形成的可溶性盐为:AgNO3 、K2CO3 、Fe2(SO4)3、BaCl2,
故答案为:AgNO3 、K2CO3 、Fe2(SO4)3、BaCl2.
本题解析:
本题难度:一般
2、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。 制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。 用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe( SO4)2标准溶液滴定Ti3+至全部生成Ti4+。 请回答下列问题:?
(1)TiCl4水解生成TiO2·xH2O的化学方程式为____。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是____。
(3)下列可用于测定TiO2粒子大小的方法是____(填字母代号)。
a.核磁共振法
b.红外光谱法
c.质谱法
d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是____ ;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
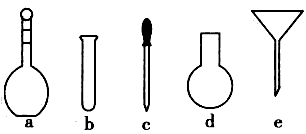
(5)滴定终点的现象是____。
(6)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样wg,消耗c mol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为____。
(7)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果___。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果____。
参考答案:(1)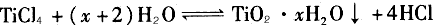
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明 CI-已除净
(3)d
(4)抑制NH4Fe(SO4)2水解;a、c
(5)溶液变为红色
(6)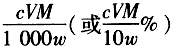
(7)①偏高②偏低
本题解析:
本题难度:一般
3、简答题 (1)欲配制500mL浓度为0.2mol/L的NaOH溶液,需要NaOH固体______g,称量固体时,应先在天平的左盘放一个______,称出其质量,再将NaOH固体置于其中称量.然后在______里加入适量的水,将上述固体溶解,待______后,转移到500mL的容量瓶中,洗涤,定容,翻转摇匀.
(2)在实验(1)中,若其它操作均正确,但定容时俯视刻度线,则所得溶液的浓度______(填“大于”、“等于”或“小于”)0.2mol/L.
(3)在实验(1)中,若NaOH溶液在转移至容量瓶时洒落少许,则所得溶液的浓度______(填“大于”、“等于”或“小于”)0.2mol/L.
参考答案:(1)500mL浓度为0.2mol/L的NaOH溶液中含有氢氧化钠的物质的量为:n(NaOH)=0.2mol/L×0.5L=0.1mol,m(NaOH)=40g/mol×0.1mol=4.0g;
称量氢氧化钠时,将氢氧化钠盛放在小烧杯中称量;将称量好的氢氧化钠放入小烧杯中溶解,待溶解的氢氧化钠溶液冷却后,转移到500mL容量瓶中,
故答案为:4.0;小烧杯;小烧杯;冷却;
(2)定容时俯视刻度线,会导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,即大于0.2mol/L,故答案为:大于;
(3)若NaOH溶液在转移至容量瓶时洒落少许,会导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,即小于0.2mol/L,故答案为:小于.
本题解析:
本题难度:一般
4、选择题 一定量的质量分数为14%的KOH溶液,若蒸发掉100g水后,其质量分数变为28%,体积为125mL,且蒸发过程中无晶体析出,则浓缩后的KOH溶液的物质的量浓度为( )
A.2.2?mol?L-1
B.4?mol?L-1
C.5?mol?L-1
D.6.25?mol?L-1
参考答案:设14%氢氧化钾溶液的质量为m,蒸发前后溶质的质量不变,则有m×14%=(m-100g)×28%,解得m=200g,
28%的氢氧化钾溶液中含有氢氧化钾的物质的量为(200-100)g×28%56g/mol=0.5mol,
所得溶液的物质的量浓度为0.5mol0.125L=4mol/L,
故选:B.
本题解析:
本题难度:一般
5、选择题 同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是3:2:1,则三溶液中氯离子的物质的量浓度之比为
[? ]
A、3 :4 :3
B、1 :2 :3
C、1 :1 :1
D、6 :3 :2
参考答案:B
本题解析:
本题难度:一般