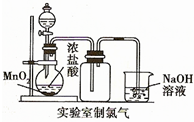
1、简答题 如图是实验室制取氯气并以氯气为原料进行特定反应的装置.其中:A中盛有MnO2,B中盛有浓盐酸.
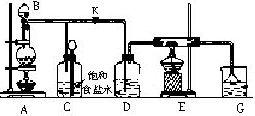
(1)仪器B的名称______.
(2)C中盛有饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的______气体.
(3)仪器D用来干燥氯气,其中盛放的试剂是______.
(4)E中装有铁粉,其中发生的反应的化学方程式是______.
(5)G中盛有NaOH溶液,目的是______.其中发生反应的离子方程式是______.
参考答案:(1)由图可知,仪器B为分液漏斗,答案为:分液漏斗;
(2)浓盐酸有挥发性,所以氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,故答案为:HCl;
(3)浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,故答案为:浓硫酸;
(4)氯气有强氧化性,能把变价金属氧化成最高价态,所以氯气和铁反应的生成物是氯化铁,故答案为:2Fe+3Cl2?△?.?2FeCl3;
(5)氯气有毒,污染环境,所以不能排空,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水,所以可用氢氧化钠吸收多余的氯气,
故答案为:吸收多余氯气,防止污染空气;Cl2+2OH-=Cl-+ClO-+H2O.
本题解析:
本题难度:一般
2、实验题 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,用KMnO4、KClO3氧化浓盐酸可快速制取氯气。根据上述反应原理,有人提出能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢。某课外小组在实验室进行了探索性实验,设计了如图装置:
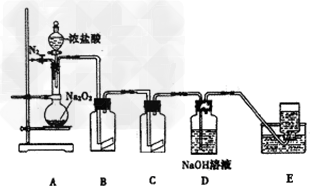
操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品。
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置E中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
⑴写出KClO3氧化浓盐酸制取Cl2的离子方程式____________。
⑵装置B中湿润的红色布条褪色,说明A中有 ___________(填化学式)生成,装置C中为湿润的KI淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因________。
⑶装置D的作用是_____________________________。
⑷写出生成O2的可能的反应方程式___________________________。
⑸实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式____________? 。综合上述实验,请分析实验室 ____________(填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是___________________________。
参考答案:
(1)ClO3-+5Cl-+6H+=3Cl2↑+3H2O
(2)Cl2;4H+ + 4I-+ O2 === 2I2 + 2H2O
(3)吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气
(4)2Na2O2 + 2H2O==4NaOH+ O2
(5)Na2O2 + 4HCl == Cl2+ 2NaCl + 2H2O;否?
?Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O混在Cl2中(或:实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢,其他合理答案均可)
本题解析:
本题难度:一般
3、选择题 下列实验装置图正确的是( )
A.
B.
C.
D.
参考答案:B
本题解析:
本题难度:简单
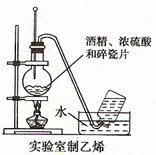
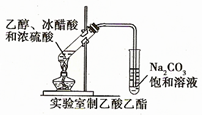
4、实验题 如下图的实验装置可用于实验室中制取乙炔。

?请回答下列问题:
(1)图中,A管的作用是______________ ,制取乙炔的化学方程式为_________________________ 。
(2)将制得的乙炔通入酸性KMnO4溶液中可观察到的现象是___________________ , 这是由于乙炔发生了_____________ 反应。
(3)将制得的乙炔通入足量的溴的四氯化碳溶液中,发生反应的化学方程式:_______。
(4)为了安全,乙炔气体在点燃前应______________ ,乙炔燃烧时的现象是___________________ 。
参考答案:(1)通过调整A管的高度来控制电石与水的反应;CaC2+2H2O→Ca(OH)2+C2H2↑
(2)酸性KMnO4溶液的颜色逐渐褪去;氧化
(3)“略”
(4)验纯;明亮的火焰,并伴有大量的浓烟
本题解析:
本题难度:一般
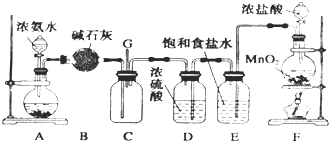
5、简答题 某化学兴趣小组利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置.
请回答下列问题:
(1)装置A中的固体物质不宜选用______(填字母编号).
a.无水氯化钙b.氢氧化钠c.氧化钙d.碱石灰e.无水硫酸铜
(2)写出装置F中发生反应的离子方程式:______;E装置的作用为______.
(3)通入C装置的两根导管左边较长、右边较短,原因是____________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.当有0.15molCl2参与反应时,则生成的气体在标准状况下的体积为______.
(5)上述装置还存在一处明显的缺陷,你认为改进的措施是______.
参考答案:(1)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,b.氢氧化钠溶解于水时放出热量c.氧化钙和水反应生成碱且放出大量热,d.碱石灰是碱性物质,且溶于水时放热,a.无水氯化钙溶于水呈中性,且与氨气反应,e.无水硫酸铜溶于水时吸热,
故选ae;
(2)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1-△.Mn2++C12↑+2H2O,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,装置的作用为除去氯气中混有的氯化氢,
故答案为:MnO2+4H++2C1-△.Mn2++C12↑+2H2O;除去氯气中混有的氯化氢;
(3)左边进入的为氨气,右边进入的为氯气,密度不同,则导管左边较长、右边较短使密度大的氯气与密度小的氨气较快地均匀混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,该反应为3Cl2+8NH3═N2+6NH4Cl,当有0.15molCl2参与反应时,
3Cl2 +8NH3 ═N2 +6NH4Cl
3mol 1mol
0.15mol n(N2)
n(N2)=0.05mol,V=n×Vm=0.05mol×22.4mol/L=1.12L,
故答案为:1.12L;
(5)氯气是有毒的气体,缺少尾气处理装置,可用碱液进行吸收,
故答案为:在G处连接一尾气处理装置;
本题解析:
本题难度:一般