1、选择题 下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是
[? ]
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
参考答案:B
本题解析:
本题难度:简单
2、选择题 将2.3 g金属钠投入100 g水中,反应结束后,溶液中溶质的质量分数计算式表示正确的是( )
A.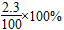
B.
C.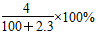
D.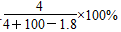
参考答案:B
本题解析:2Na+2H2O=2NaOH+H2↑,根据反应可知2.3gNa投入到100g水中产生0.1gH2,所以溶质的质量分数计算式为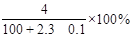 。答案选B。
。答案选B。
点评:钠与水反应后溶质质量分数的计算要考虑产生氢气的质量不算在溶液的质量之中。
本题难度:一般
3、简答题 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为水,B为过氧化钠,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为______,
C中发生反应的离子方程式为______;
(2)利用上述装置还可以验证物质的性质,如设计证明氧化性:KMnO4>Cl2,并制取漂白液,则A中加浓盐酸,B中加______溶液,C中发生反应的离子方程式为______.
(3)利用上述装置还可以验证SO2的化学性质,A为硫酸,B为亚硫酸钠固体,那么C中盛有______溶液时可验证其还原性;?而C中盛有______溶液时可验证其漂白性.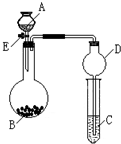
参考答案:(1)过氧化钠与水反应生成氧气,能氧化具有还原性的FeCl2,生成黄色的Fe3+,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:溶液由浅绿色逐渐变为(棕)黄色,4Fe2++O2+4H+=4Fe3++2H2O;
(2)KMnO4>Cl2,酸性高锰酸钾与浓盐酸反应生成氯气,B中应加入高锰酸钾,制备漂白液,用氯气和NaOH溶液反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:高锰酸钾(酸性高锰酸钾);Cl2+2OH-=Cl-+ClO-+H2O;
(3)SO2具有还原性,可与氯水等氧化性物质反应,SO2具有漂白性,可使品红褪色,所以C中应盛有品红,
故答案为:氯水(或溴水或酸性高锰酸钾溶液);品红.
本题解析:
本题难度:一般
4、选择题 下列有关焰色反应的实验操作注意事项的说明,其中正确的是(? )
①钾的焰色要透过蓝色钴玻璃观察②先将铂丝灼烧到与原火焰颜色相同,再蘸取被检物质③每次实验完,均要用盐酸洗净铂丝④实验时,要尽可能选用本身颜色较浅的火焰
A.只有①
B.只有③
C.①②③
D.全部
参考答案:D
本题解析:①~④的目的分别是:如不透过钴玻璃,则无法观察到浅紫色;避免其他颜色干扰;用盐酸洗去被灼烧物质;较浅火焰能减少对被检物质的干扰。
本题难度:简单
5、选择题 已知NaCl、Na2SO4、Na3PO4三种溶质的物质的量浓度之比是1:1:2,三种溶液的体积比为2:2:1,则这三种溶液中Na+个数比是
A.3:2:1
B.1:2:3
C.9:3:1
D.1:3:9
参考答案:B
本题解析:略
本题难度:简单