1、选择题 下列变化需加入还原剂才能完成的是(? )
A.KMnO4 MnO2
MnO2
B.
 CO2
CO2
C.H2SO4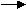 SO2
SO2
D.Br- Br2
Br2
参考答案:C
本题解析:略
本题难度:简单
2、选择题 在常温下取下列四气态烃各1mol,分别在足量的氧气中燃烧,消耗的氧气最多的是( )
A.CH4
B.CH3CH3
C.C2H4
D.C6H6
参考答案:A.1molCH4消耗氧气为1mol×(1+44)=2mol;
B.1molCH3CH3消耗氧气为1mol×(2+64)=3.5mol;
C.1molC2H4消耗氧气为1mol×(2+44)=3mol;
D.1molC6H6消耗氧气为1mol×(6+64)=7.5mol,
显然D中消耗氧气最多,
故选D.
本题解析:
本题难度:简单
3、选择题 下列化常用语中,正确的是
A.两个氧分子 — O2
B.氢氧化铁的化学式 — Fe(OH)3
C.CO2 中氧元素的化合价为+ 2价
D.水通电得到氧气的化学方程式是2H2O=O2↑+2H2↑
参考答案:B
本题解析:A不正确,应该是2O2。CO2 中氧元素的化合价为-2价,C不正确。D不正确,缺少反应条件,应该是2H2O O2↑+2H2↑,所以正确的答案选B。
O2↑+2H2↑,所以正确的答案选B。
本题难度:简单
4、计算题 (本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
参考答案:56.24g(3分) 57.0.14(3分) 58.43.2(4分)(给过程分)
59.Br2 0.13 mol、SO2 0.13 mol、HBr 0.04 mol(4分,三种成分判断正确2分,物质的量都对2分)
本题解析:56.根据反应方程式可知:n(Br2)=n(CO2)=" 3.36" L÷22.4L/mol=0.15mol;所以m(Br2)= 0.15mol×160g/mol=24g;
57.根据反应过程中电子转移数目相等可知:n(e-)="0.1" mol×1+0.6 mol×1=0.7mol,所以n(NaBrO3)= 0.7mol÷5=0.14mol;
58.向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠,说明溶液中的NaBr和NaBrO3完全转化为Br2。n(NaBr)+n(NaBrO3)=2n(H2SO4)="2×(2" mol/L×0.3mol)=1.2mol.n(Br2)=" 81.6" g÷160g/mol=0.51mol,说明在溶液则溶解Br2的物质的量是1.2mol÷2-0.51mol=0.09mol。若改为加入180 mL硫酸,则硫酸不足量产生的溴单质按照硫酸来计算。n(H2SO4)= n(Br2)="0.18L×2" mol/L=0.36mol,在溶液中溶解的溴单质的物质的量是0.09mol。所以可回收的液溴的质量是(0.36mol-0.09mol) ×160g/mol=43.2g。
59.由于产生的红棕色的气体且残留物中不含溴元素,则溴元素完全转化为Br2,该红棕色气体中有Br2,NaBr与足量浓硫酸反应的方程式是:2NaBr+2H2SO4(浓)  Na2SO4+SO2↑+H2O。可见n(Br2)=n(SO2).若Br元素完全被氧化为Br2,根据Br元素守恒可得n(Br2)=" 0.3" mol÷2=0.15mol。NaBr被浓硫酸氧化,则浓硫酸钡还原变为SO2,根据氧化还原反应中电子转移数目相等可知, n(SO2)=0.15mol,n(Br2):n(SO2)= 1:1.将气体通入溶液中,且无气体逸出,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr;SO2 + Na2SO3→ 2NaHSO3;HBr + Na2SO3→ NaHSO3 +NaBr可知需要消耗0.60mol 的Na2SO3>0.56mol,故说明在气体中除Br2、SO2外,还有HBr。设气体中Br2为x mol,则HBr为(0.3-2x)mol,SO2为x mol,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr可知Br2反应消耗的Na2SO3的物质的量是x,SO2 + Na2SO3→ 2NaHSO3中SO2反应消耗的Na2SO3的物质的量是x,整个溶液包括反应产生的HBr和原混合气体中的HBr共0.3mmol发生反应HBr + Na2SO3→ NaHSO3 +NaBr消耗的Na2SO3的物质的量是0.3mol,所以x + 0.3 + x=0.56 解得x=0.13mol,因此n(Br2)= n(SO2)= 0.13mol;n(HBr)= 0.04mol。
Na2SO4+SO2↑+H2O。可见n(Br2)=n(SO2).若Br元素完全被氧化为Br2,根据Br元素守恒可得n(Br2)=" 0.3" mol÷2=0.15mol。NaBr被浓硫酸氧化,则浓硫酸钡还原变为SO2,根据氧化还原反应中电子转移数目相等可知, n(SO2)=0.15mol,n(Br2):n(SO2)= 1:1.将气体通入溶液中,且无气体逸出,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr;SO2 + Na2SO3→ 2NaHSO3;HBr + Na2SO3→ NaHSO3 +NaBr可知需要消耗0.60mol 的Na2SO3>0.56mol,故说明在气体中除Br2、SO2外,还有HBr。设气体中Br2为x mol,则HBr为(0.3-2x)mol,SO2为x mol,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr可知Br2反应消耗的Na2SO3的物质的量是x,SO2 + Na2SO3→ 2NaHSO3中SO2反应消耗的Na2SO3的物质的量是x,整个溶液包括反应产生的HBr和原混合气体中的HBr共0.3mmol发生反应HBr + Na2SO3→ NaHSO3 +NaBr消耗的Na2SO3的物质的量是0.3mol,所以x + 0.3 + x=0.56 解得x=0.13mol,因此n(Br2)= n(SO2)= 0.13mol;n(HBr)= 0.04mol。
考点:考查工业上从海水中的NaBr获得溴单质的方法、回收过程中产生的气体的成分的确定、守恒方法在回收的物质的质量的计算的应用的知识。
本题难度:困难
5、选择题 下列说法不正确的是?(?)
① H2O2分子中既含极性键又含非极性键
② 若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④周期表中共有18个列,其中形成化合物种类最多的元素在第14列
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥ 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦ 由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧ 原子序数为34号的元素属于长周期的副族元素
A.②⑤⑥⑧
B.①③④⑤
C.②④⑤⑦
D.③⑤⑦⑧
参考答案:A
本题解析:H2O2分子中既含极性键又含非极性键,故①正确;若R2—和M+的电子层结构相同,则原子序数:M>R,所以②错误;F2、Cl2、Br2、I2熔点随相对分子质量增大而升高,故③正确;周期表中共有18个列,其中形成化合物种类最多的元素在第14列,因为C元素在14列,所以④正确;若X的质子数为a,中子数为b,则原子可表示为ab+aX,故⑤错误;由于非金属性Cl>Br>I,但是酸性HI>HBr> HCl,故⑥错误;由于氨和水分子之间能形成氢键,NH3分子极易溶于水,故⑦正确;原子序数为34号的元素为Se,属于长周期的主族元素,故⑧错误,所以说法不正确的有②⑤⑥⑧,故答案为A。
点评:本题考查了化学术语表达的正确性,题的信息量比较大,比较耗时,难度适中。
本题难度:简单