1、选择题 有一Na2S,Na2SO3和Na2SO4混合物,经测是含硫25.6%(质量分数),则比混合物含氧量为( )
A.37.6%
B.36.8%
C.51.2%
D.无法计算
参考答案:在这三种物质中,钠元素与硫元素的原子个数比为2:1,也就是钠元素和硫元素的质量比是定值为46:32,硫元素的质量分数为25.6%,所以钠元素的质量分数是25.6%×4632=36.8%,故氧元素的质量分数为:1-25.6%-36.8%=37.6%.
故选:A.
本题解析:
本题难度:一般
2、填空题 (6分)某双原子分子构成的气体,其摩尔质量为M (g·mol-1),已知阿伏加德罗常数为NA (mol-1),标准状况下气体摩尔体积为Vm (L·mol-1),现有质量为n g的该气体,则:
(1) 该气体的物质的量为?mol。
(2) 该气体在标准状况下的体积为?L。
(3) 该气体所含原子总数为?个。
参考答案:n/M,? nVm/M,? 2nNA/M? (每空2分)
本题解析:考查物质的量的有关计算。
(1)根据n=m/M可知,该气体的物质的量为n/Mmol。
(2)根据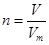 可知,标准状况下的体积是n/Mmol×Vm L·mol-1=nVm/ML
可知,标准状况下的体积是n/Mmol×Vm L·mol-1=nVm/ML
(3)用于分子是双原子分子,所以该气体所含原子总数为n/M×2×NA=2nNA/M。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是(?)
A.1 mol甲醇中含有C—H键的数目为4NA
B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24 L己烷含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
参考答案:D
本题解析:在审准各项条件的基础上还要注意以下几点:
(1)甲醇中含有C—O键。
(2)溶液中微粒的个数与溶液的体积有关。
(3)应用气体摩尔体积时要注意物质的状态。
A项,1个甲醇分子中含3个碳氢键,1 mol甲醇中含3 mol碳氢键,A项错误;B项,缺少溶液的体积,无法计算,B项错误;C项,标准状况下,己烷为液态,不能使用22.4 L·mol-1进行计算,C项错误;D项,过氧化钠与水反应,每生成1个氧气分子转移2个电子,生成0.2 mol氧气,转移的电子数为0.4NA,D项正确。
本题难度:一般
4、选择题 下列各溶液中,相关微粒物质的量浓度关系不正确的是高
A.0.1 mol·L-1NH3?H2O溶液中: c (NH4+) < c (OH-)
B.0.1 mol·L-1NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+ c (H2CO3)=" 0.1" mol·L-1
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4> NH4Cl > NH4HSO4
参考答案:D
本题解析:
答案:D
A、正确,NH3·H2O和H2O均电离出OH― , c (NH4+) < c (OH-);
B.正确,0.1 mol·L-1NH4Cl溶液中:电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.正确,0.1 mol·L-1Na2CO3溶液中:物料守恒,c((HCO3-)+c(CO3-)+ c (H2CO3)=" 0.1" mol·L-1
D.不正确,浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4< NH4Cl < NH4HSO4,NH4HSO4中H+ 抑制NH4+ 水解。CH3COONH4中CH3COO―促进NH4+ 的水解。
本题难度:一般
5、选择题 使等体积的AlCl3.CaCl2.NaCl溶液中的Cl-完全转化为AgCl沉淀,所用0.1 mol/L AgNO3溶液的体积相同,则这三种溶液的物质的量浓度之比为( )
A.1:2:3
B.1:1:1
C.2:3:6
D.6:3:2