1、填空题 铁及其化合物在生产、生活中应用广泛.
(1)一定条件下,Fe与CO2可发生反应:2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)该反应的平衡常数(K)随温度(T)升高而增大.
①该反应的平衡常数K=______.(填表达式)②下列措施中,能使平衡时
增大的是______(填标号).
A.升高温度?B.增大压强? C.充入一定量CO?D.再加一些铁粉
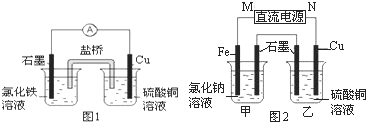
(2)图1装置发生反应的离子方程式为______.
(3)图2装置中甲烧杯盛放100mL?0.2mol/L的NaCl溶液,乙烧杯盛放100mL?0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红.
①电源的M端为______极,甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的化学方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重?0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
参考答案:(1)①2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)平衡常数表达式k=c3(CO)c3(CO2),故答案为:c3(CO)c3(CO2);
②2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)该反应的平衡常数(K)随温度(T)升高而增大,23Fe(s)+CO2(g)?13Fe2O3(s)+CO(g)的平衡常数表达式k=c(CO)c(CO2),应升高温度使之增大,故答案为:A;
(2)装置1为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe+2e-═2Fe2+,反应的总方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g64g/mol=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
根据甲烧杯产生气体的电极反应计算生成气体的体积,
?2H2O+2e-═2OH-+H2↑,
? 2mol? 22.4L
?0.02mol? ?V
V=22.4L×0.02mol2mol=0.224L,即224ml,
故答案为:224.
本题解析:
本题难度:一般
2、选择题 在425℃时,在1升密闭容器中进行的反应H2(g)+I2(g) 2HI(g) 达到平衡,分析下面示意图所表示的涵义,其中与下面的说法的联系不是很紧密的是
2HI(g) 达到平衡,分析下面示意图所表示的涵义,其中与下面的说法的联系不是很紧密的是
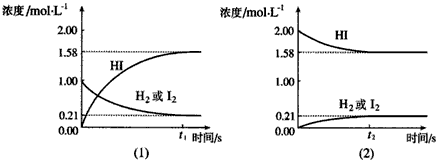
[? ]
A.同温同压下,从正、逆方向都可以建立平衡
B.同温下,压强改变对平衡无影响
C.此可逆反应的正反应进行程度更深,所以正反应为熵增、焓减
D.相同条件下,分别从正、逆方向建立等同的平衡状态,所须时间可能不同
参考答案:C
本题解析:
本题难度:一般
3、选择题
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.下列判断正确的是( )
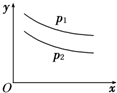
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a+1<b